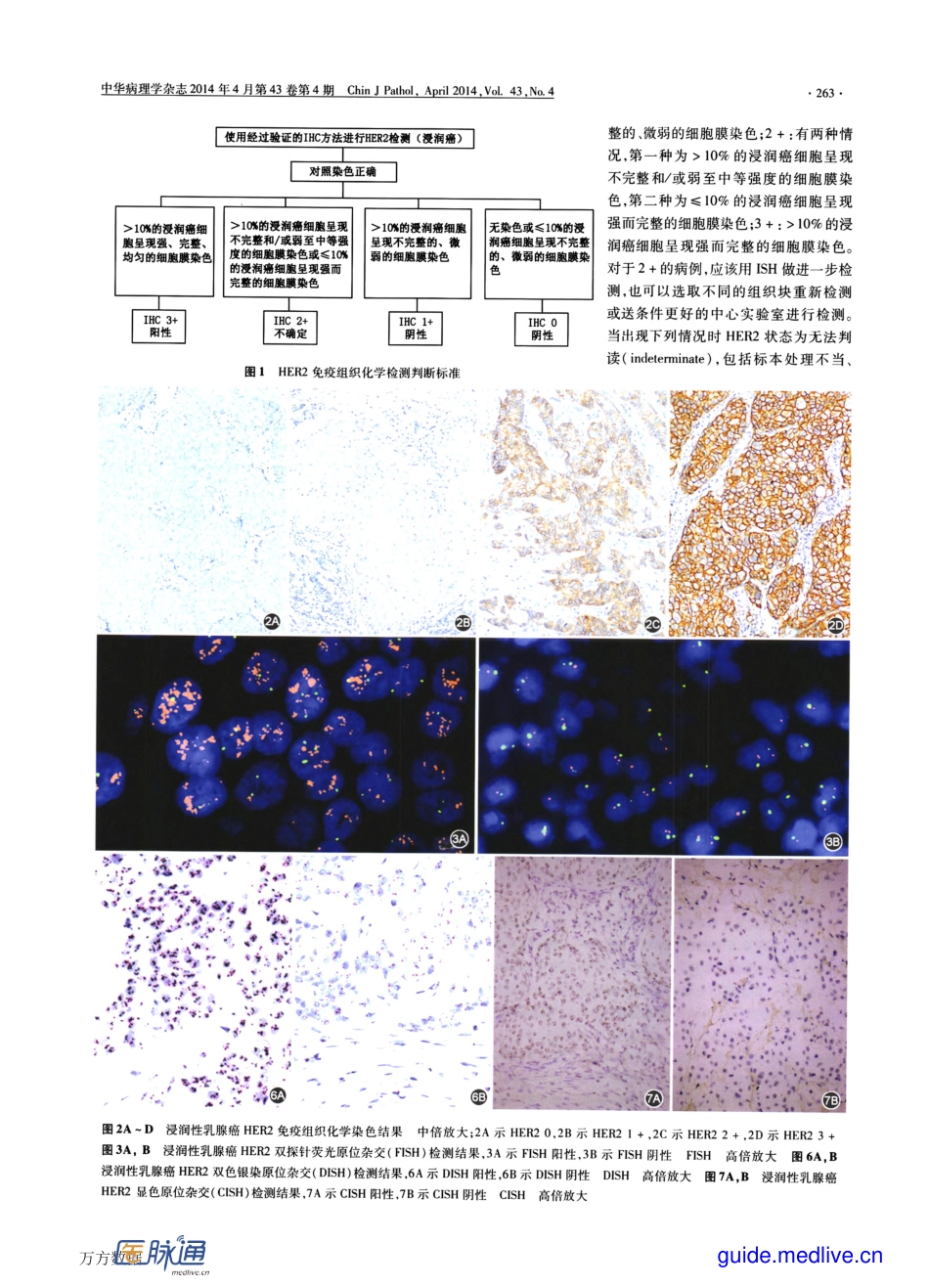
·262·生堡痘堡堂盘圭!Q!垒生兰旦笠箜鲞筮兰塑g!也』里!!!!!:垒P曼!!!!兰:!尘:箜:盟!:垒乳腺癌HER2检测指南(2014版)《乳腺癌HER2检测指南(2014版)》编写组正确检测和评定乳腺癌的HER2蛋白表达和基因扩增状态对乳腺癌的临床治疗和预后判断至关重要⋯。HER2检测结果不仅涉及患者是否适合针对HER2的靶向治疗,并且对内分泌治疗、化疗方案的选择及预后评估起指导作用L2J。2006年我国《乳腺癌HER2检测指南》的发布¨1对提高乳腺癌HER2检测水平起到了积极作用。2009年我国病理学家再次发布了《乳腺癌HER2检测指南(2009版)》【4J,强调了HER2检测结果的判读标准、检测的技术路线、内部及外部质量控制等,进一步推进了我国乳腺癌HER2检测的标准化。近年来针对HER2阳性乳腺癌的曲妥珠单抗在临床取得了较好疗效。新药如拉帕替尼、帕妥珠单抗、T—DMl等也逐渐被用于临床。与此同时,HER2检测中也出现了一些新的问题∞o。2013年,美国临床肿瘤学会/美国病理医师学院(ASCO/CAP)公布了在2007版ASCO/CAPHER2检测指南∞。基础上的更新版本¨1。本指南结合我国实际情况,在《乳腺癌HER2检测指南(2009版)》的基础上,补充相关领域的新内容和新观点,旨在进一步提高HER2检测的可重复性和准确性,更有效地评估乳腺癌患者的预后,为患者的个体化治疗提供依据。一、检测方法推荐采用免疫组织化学(IHC)法检测HER2受体蛋白的表达水平,应用原位杂交(insituhybridization,ISH)法检测HER2基因扩增水平。ISH包括荧光ISH(fluorescenceinsituhybridization,FISH)和亮视野ISH。常用的亮视野ISH方法有显色ISH(chromogenicinsituhybridization,CISH)¨圳和银增强ISH(silver—enhancedinsituhybridization,SISH)¨““J。本指南推荐IHC与ISH相结合的检测策略。二、检测时机及临床病理联系所有乳腺原发性浸润癌都应进行HER2检测。只要能获取肿瘤组织,对复发灶或转移灶也应该进行HER2检测。如HER2检测结果为不确定,则应使用另一种检测方法进行检测,或对该患者的其他样本进行检测。加强临床病理沟通有助于对HER2检测结果的正确诠释和对HER2靶向治疗疗效的客观评价。临床医师和病理医师均需注意HER2检测结果是否与组织病理学特征相符,如组织学分级为1级的DOI:10.3760/cma.j.issn.0529-5807.2014.04.012执笔人单位:610041成都,四川I大学华西医院病理研究室病理科(步宏,E—mail:hongbu@SCtl.edu.cn);200032复旦大学附属肿瘤医院病理科复旦大学上海医学院...