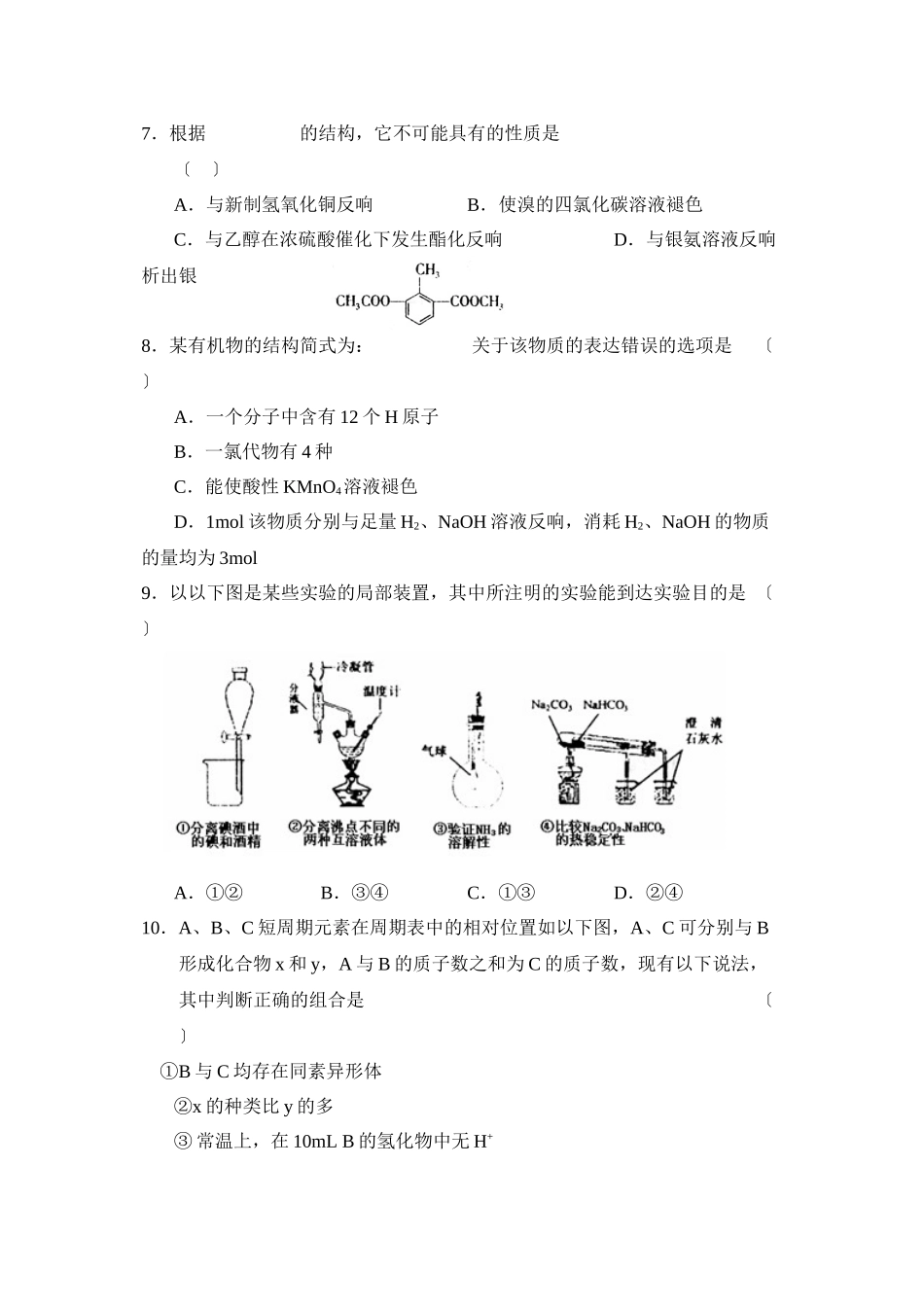
2023学年度山东省济宁市高三期末考试化学试题本试卷分为第一卷〔选择题〕和第二卷〔非选择题〕两局部。共100分,考试时间100分钟。相对原子质量:H1C12N14O16Cl35.5Ti48第I卷〔选择题共54分〕本卷须知:1.答第I卷前,考生务必将自己的姓名、准考证号、考试科目用铅笔涂写在答题卡上。2.每题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其它答案标号。不能答在试卷上。一、选择题〔此题包括18小题,每题3分,共54分,每题只有一个选项符合题意〕1.2023年诺贝尔化学奖授予德国化学家GerhardErtl,以表彰他对固体外表化学研究过程中的重大发现。使CO、NOx等在铂外表发生化学反响转变成无毒气体,以减少汽车尾气中有毒气体的排放,正是此项研究的重要应用之一。以下有关说法不正确的选项是〔〕A.CO在铂外表被氧化生成CO2,铂起催化作用B.汽车尾气中NOx在铂外表发生复原反响的产物是N2C.CO在铂外表可能和O2、NOx反响D.NOx、CO、CO2均能与人体中的血红蛋白结合2.以下有关化学用语表达不正确的选项是〔〕A.氨气分子的电子式:B.CO2分子的结构式:O=C=OC.S2-的离子结构示意图:D.苯分子的比例模型:3.判断反响过程的自发性的目的是〔〕A.判断反响的方向B.确定反响是否一定会发生C.判断反响过程发生的速率D.判断反响过程的热效应4.以下有关说法正确的选项是〔〕A.制取蒸馏水是把杂质从水中蒸出B.通过加热除去氯化铵固体中的碘单质C.在做钠与水反响的实验时,为了平安起见,应在小烧杯上盖上外表皿或玻璃片D.配制一定物质的量浓度的稀硫酸时,量取一定体积的浓硫酸注入小烧杯中,加水稀释冷却后转移到容量瓶中5.分类是化学学习和研究的常用手段。以下分类依据和结论都正确的选项是〔〕A.H2O、HCOOH、Cu2〔OH〕2CO3均含有氧元素,都是氧化物B.HClO、浓H2SO4、HNO3均具有氧化性,都是氧化性酸C.HF、CH3COOH、CH3CH2OH都易溶于水,都是电解质D.NaF、MgO、AlCl3均由活泼金属和活泼非金属化合而成,都是离子化合物6.以下表达正确的选项是〔〕A.纯锌与稀硫酸反响时,参加少量CuSO4溶液,可使反响速率加快B.甲醇和氧气以及KOH溶液构成的新型燃料电池中,其负极上发生的反响为:CH3OH+6OH-+6e-===CO2+5H2OC.在铁上镀铜时,金属铜作阴极D.电解精炼铜时,电解质溶液中铜离子浓度不变7.根据的结构,它不可能具有的性质是〔〕A.与新制氢氧化铜反响B.使溴的四氯化碳溶液褪色C.与乙醇在...