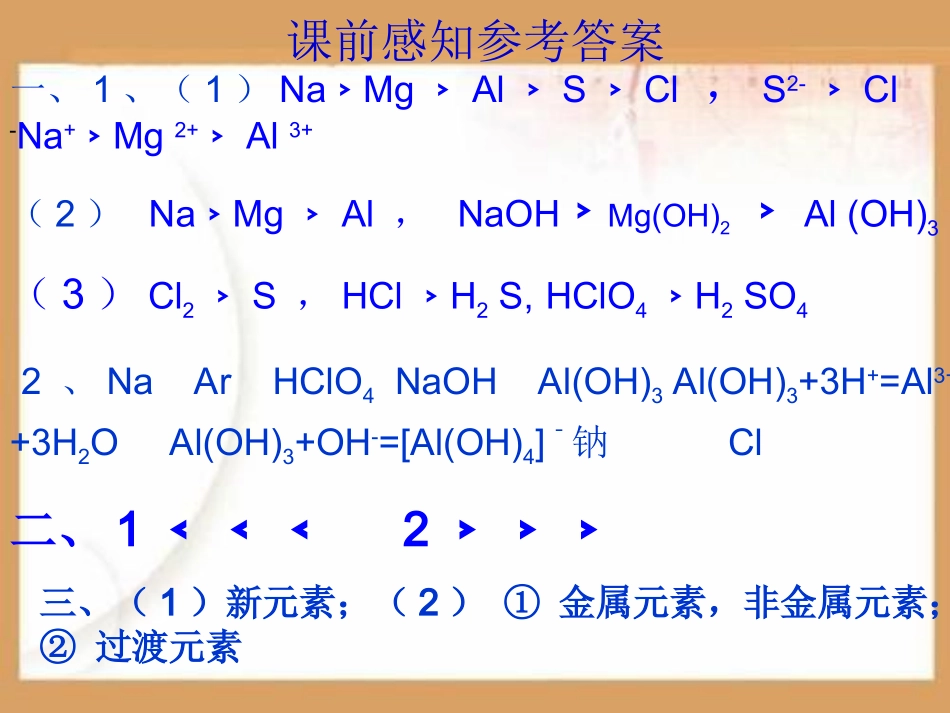
第三节元素周期表的应用(复习课)复习目标1.掌握同周期内元素的递变规律2.掌握同主族内元素性质递变规律3.综合利用元素在周期表中的位置、其原子结构及性质递变解决实际问题。课前感知参考答案一、1、(1)Na﹥Mg﹥Al﹥S﹥Cl,S2-﹥Cl-Na+﹥Mg2+﹥Al3+(2)Na﹥Mg﹥Al,NaOH﹥Mg(OH)2﹥Al(OH)3(3)Cl2﹥S,HCl﹥H2S,HClO4﹥H2SO42、NaArHClO4NaOHAl(OH)3Al(OH)3+3H+=Al3++3H2OAl(OH)3+OH-=[Al(OH)4]ˉ钠Cl二、1﹤﹤﹤2﹥﹥﹥三、(1)新元素;(2)①金属元素,非金属元素;②过渡元素同一周期(从左到右)最外层电子数逐渐_______原子半径逐渐________得、失电子能力失电子能力逐渐______得电子能力逐渐______金属单质与水或酸发生置换反应的难易程度由____到_____非金属单质与氢气化合的难易程度由____到_____...