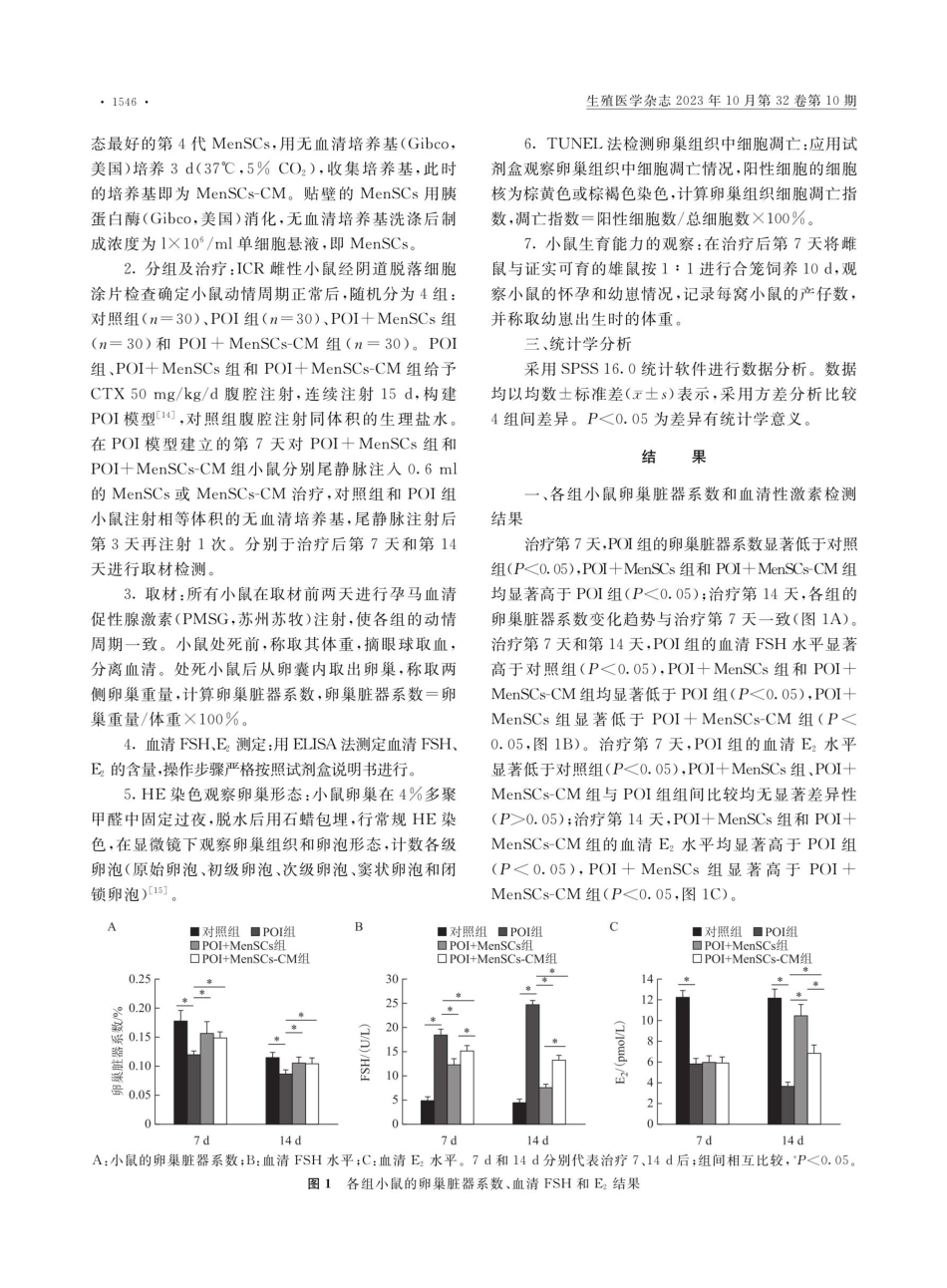
1544·生殖医学杂志2023年10月第32卷第10期DO1:10.3969/j.issn.1004-3845.2023.10.013·实验研究·经血间充质干细胞及其培养液对化疗致早发性卵巢功能不全小鼠的治疗作用余柯达,毛佳婷,柴娟,包云,师帅*(金华市人民医院生殖医学中心,金华321000)【摘要】目的探讨经血间充质干细胞(MenSCs)及其培养液(MenSCs-CM)对化疗致早发性卵巢功能不全(POI)小鼠的治疗作用。方法将健康的雌性ICR小鼠分为4组:对照组、POI组、POI+MenSCs组和POI+MenSCs-CM组。POI组、POI+MenSCs组和POI+MenSCs-CM组用环磷酰胺(CTX)建立POI模型,建模成功后分别进行对应治疗处理。测量小鼠卵巢脏器系数,HE染色检查卵巢卵泡情况,ELISA测定血清卵泡刺激素(FSH)和雌激素(E,水平,TUNEL法观察卵巢细胞凋亡情况,交配实验检测生育力,并对4组进行比较。结果治疗第7天和第14天,POI组的卵巢脏器系数均显著低于对照组(P<0.05),POI+MenSCs组和POI+MenSCs-CM组均显著高于POI组(P<0.05);治疗第7天和第14天,POI组的血清FSH水平显著高于对照组(P<0.05),POI+MenSCs组和POI+MenSCs-CM组均显著低于POI组(P<0.05);治疗第14天,POI+MenSCs组和POI+MenSCs-CM组的血清Ez水平均显著高于POI组(P<0.05)。POI+MenSCs组和POI+MenSCs-CM组的原始卵泡、初级卵泡、次级卵泡和窦状卵泡数量均显著多于POI组(P<0.05),闭锁卵泡数显著少于POI组(P<0.05)。TUNEL法结果表明,调亡细胞大部分为成熟卵泡周边及内部的颗粒细胞(GCs),POI+MenSCs组和POI+MenSCs-CM组的调亡指数均显著小于POI组(P<0.05),且两组的产仔数量和幼患体重均显著高于POI组(P<0.05)。结论来源于经血的MenSCs及其培养液可有效改善POI小鼠的卵巢功能,并可提升其生育能力。【关键词】早发性卵巢功能不全;经血;间充质干细胞;生育能力【中图分类号】R711.75Therapeuticeffectofmenstrualblood-derivedmesenchymalstemcellsandtheirculturemediumonprematureovarianinsufficiencyinmiceYUKe-da,MAOJia-ting,CHAIJuan,BAOYun,SHIShuai*CenterofReproductiveMedicine,JinhuaPeople'sHospital,JinhuaObjective:Toinvestigatethetherapeuticeffectofmenstrualblood-derivedmesenchymalstemcells(MenSCs)andtheirculturemedium(MenSCs-CM)onchemotherapy-inducedprematureovarianinsufficiency(POI)inmice.Methods:HealthyfemaleICRmiceweredividedintofourgroups:controlgroup,POIgroup,POI+MenSCsgroupandPOI+MenSCs-CMgroup....