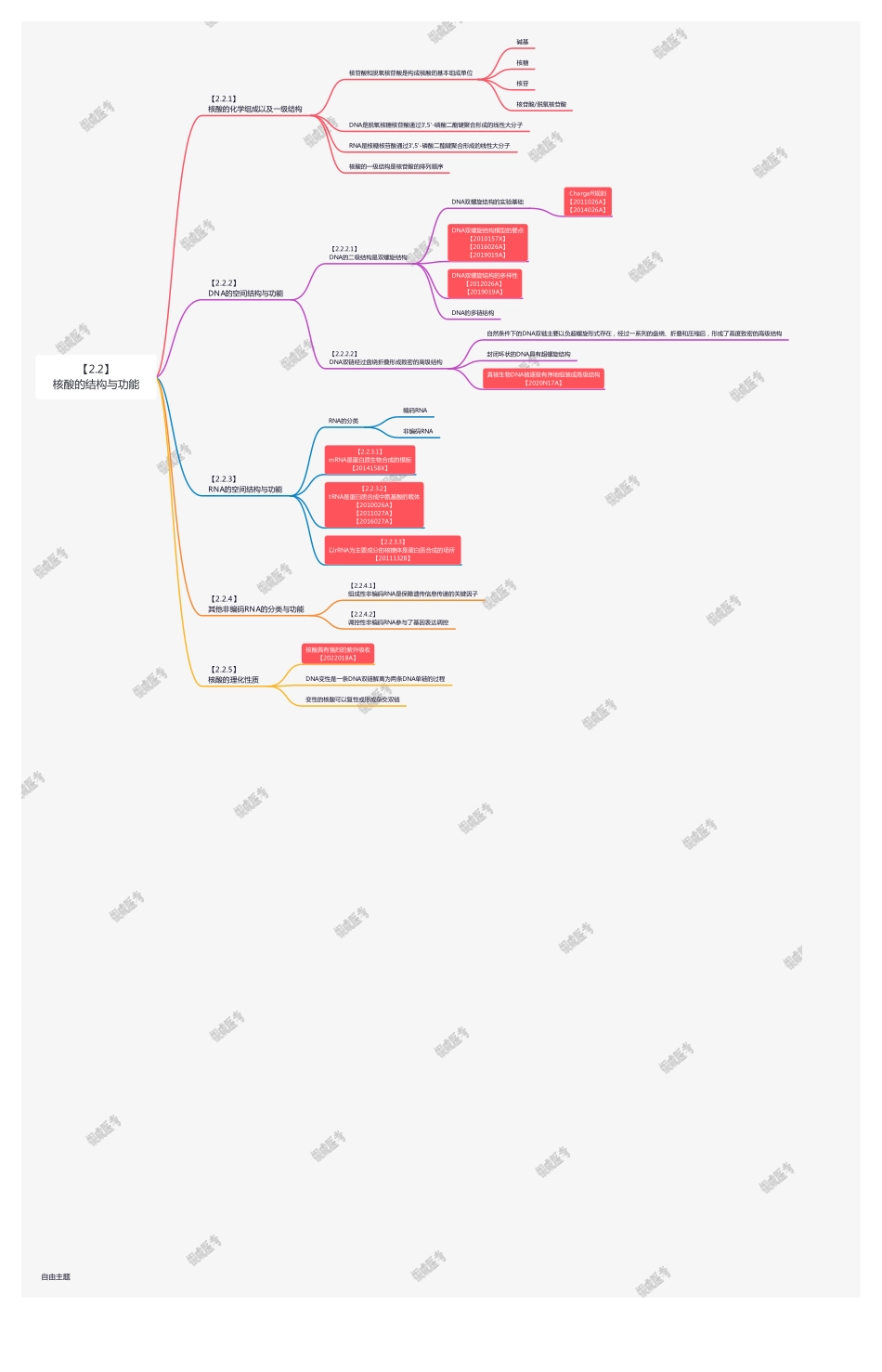
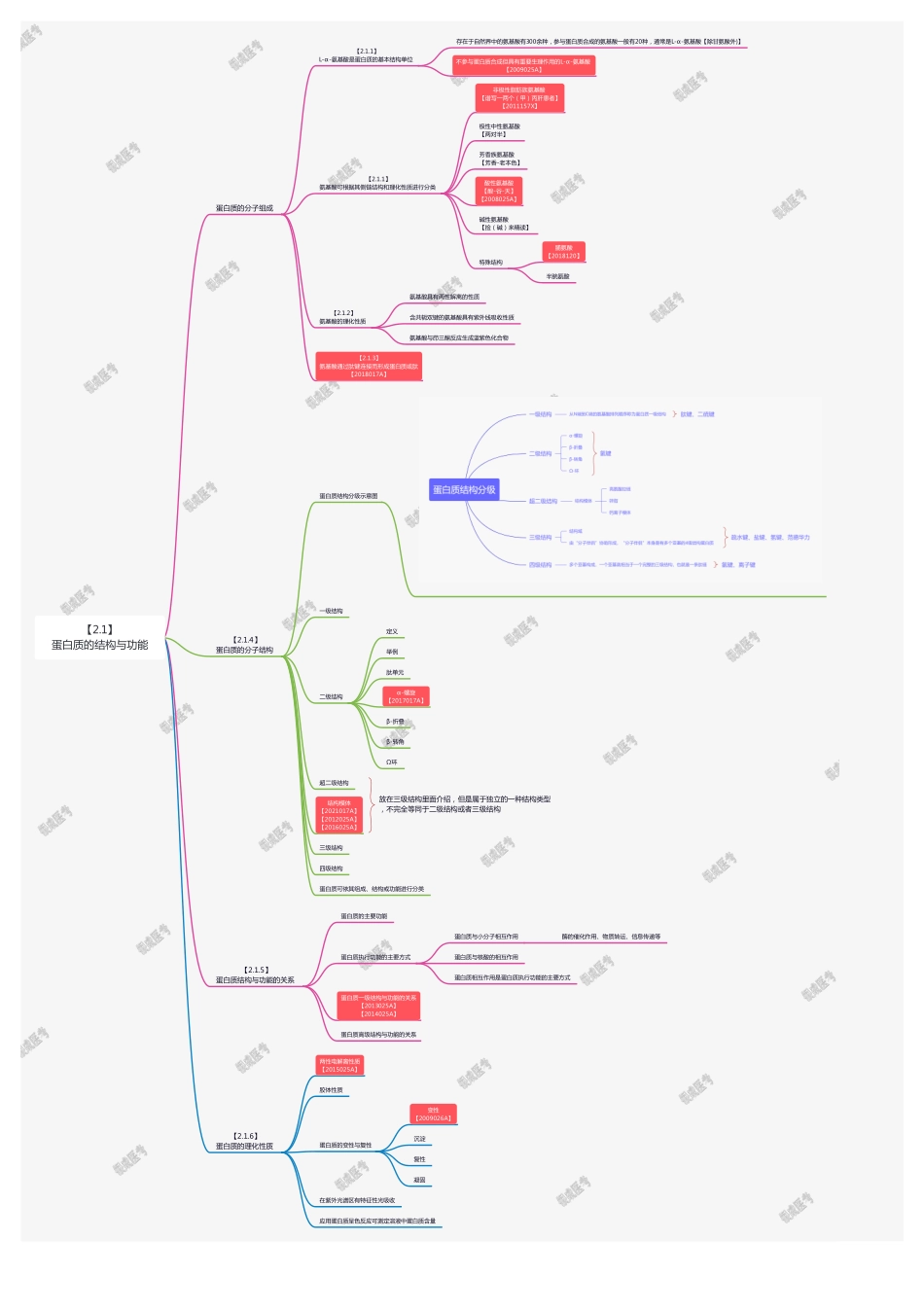
【2.2.5】核酸的理化性质核酸具有强烈的紫外吸收【2022018A】DNA变性是一条DNA双链解离为两条DNA单链的过程变性的核酸可以复性或形成杂交双链【2.2.4】其他非编码RNA的分类与功能【2.2.4.1】组成性非编码RNA是保障遗传信息传递的关键因子【2.2.4.2】调控性非编码RNA参与了基因表达调控【2.2.3】RNA的空间结构与功能RNA的分类编码RNA非编码RNA【2.2.3.1】mRNA是蛋白质生物合成的模板【2014158X】【2.2.3.2】tRNA是蛋白质合成中氨基酸的载体【2010026A】【2011027A】【2016027A】【2.2.3.3】以rRNA为主要成分的核糖体是蛋白质合成的场所【2011132B】【2.2.2】DNA的空间结构与功能【2.2.2.1】DNA的二级结构是双螺旋结构DNA双螺旋结构的实验基础Chargaff规则【2011026A】【2014026A】DNA双螺旋结构模型的要点【2010157X】【2016026A】【2019019A】DNA双螺旋结构的多样性【2012026A】【2019019A】DNA的多链结构【2.2.2.2】DNA双链经过盘绕折叠形成致密的高级结构自然条件下的DNA双链主要以负超螺旋形式存在,经过一系列的盘绕、折叠和压缩后,形成了高度致密的高级结构封闭环状的DNA具有超螺旋结构真核生物DNA被逐级有序地组装成高级结构【2020N17A】【2.2.1】核酸的化学组成以及一级结构核苷酸和脱氧核苷酸是构成核酸的基本组成单位碱基核糖核苷核苷酸/脱氧核苷酸DNA是脱氧核糖核苷酸通过3',5'-磷酸二酯键聚合形成的线性大分子RNA是核糖核苷酸通过3',5'-磷酸二酯键聚合形成的线性大分子核酸的一级结构是核苷酸的排列顺序【2.2】核酸的结构与功能自由主题【2.1.6】蛋白质的理化性质两性电解离性质【2015025A】胶体性质蛋白质的变性与复性变性【2009026A】沉淀复性凝固在紫外光谱区有特征性光吸收应用蛋白质呈色反应可测定溶液中蛋白质含量【2.1.5】蛋白质结构与功能的关系蛋白质的主要功能蛋白质执行功能的主要方式蛋白质与小分子相互作用酶的催化作用、物质转运、信息传递等蛋白质与核酸的相互作用蛋白质相互作用是蛋白质执行功能的主要方式蛋白质一级结构与功能的关系【2013025A】【2014025A】蛋白质高级结构与功能的关系【2.1.4】蛋白质的分子结构蛋白质结构分级示意图一级结构二级结构定义举例肽单元α-螺旋【2017017A】β-折叠β-转角Ω环超二级结构结构模体【2021017A】【2012025A】【2016025A】放在三级结构里面介绍,但是属于独立的一种结构类型,不完全等同于二级结构或者三级结构三级结构四级结构蛋白质可依其组成、结构或功能进行分类蛋白质...