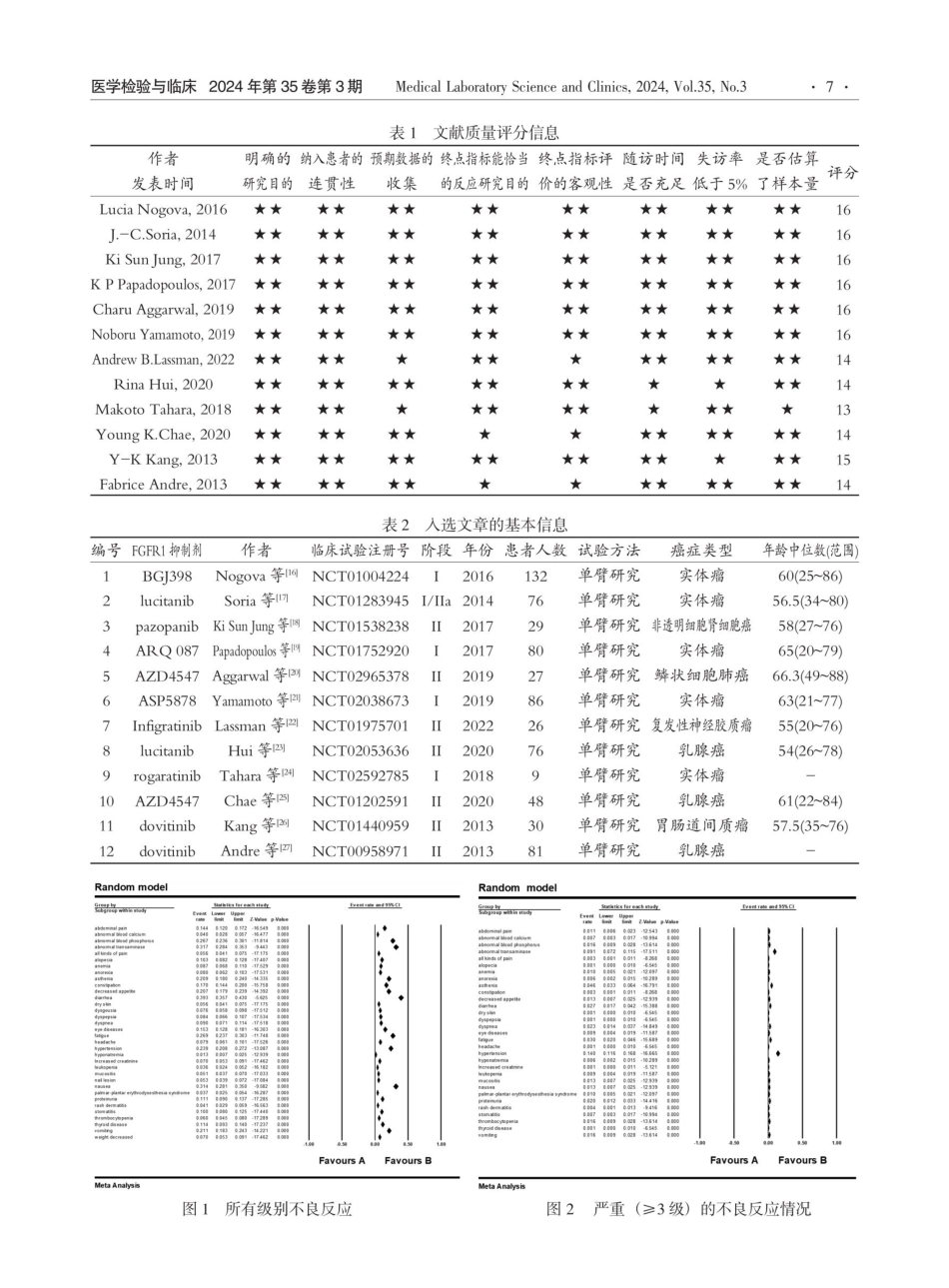
医学检验与临床2024年第35卷第3期MedicalLaboratoryScienceandClinics,2024,Vol.35,No.3·5doi:10.3969/j.issn.1673-5013.2024.03.002FGFR1抑制剂在实体瘤治疗中的安全性与有效性的临床试验研究Meta分析刘凯1王立萍1手孙福廷1孙艳丽241(潍坊市人民医院输血科,山东潍坊261041)2(潍坊医学院医学检验学院,山东潍坊261053)[摘要]目的:系统性评价临床试验研究报道中FGFR1抑制剂在实体瘤治疗中的安全性和有效性。方法:检索PubMed、Embase、CochraneLibrary、Clinicaltrials、维普、中国知网、万方数据库,筛选FGFR1抑制剂在实体瘤患者治疗中的临床试验报道,用CMA3.7软件进行Meta分析。结果:最终纳入12篇关于FGFR1抑制剂的临床试验研究报道,包括BGJ398、lucitanib、pazopanib、ARQ087、AZD4547、ASP5878、Infigratinib、rogaratinib和dovitinib共9种FGFR1抑制剂,共计700例实体瘤患者,均为单臂研究。Meta分析结果显示FGFR1抑制剂应用后引起的所有级别的总的不良反应率为96.7%。常见的有:①血液系统改变:血小板减少(6.0%)、贫血(8.7%)、白细胞减少(3.6%);②非血液系统改变:腹泻(39.3%)、转氨酶升高(31.7%)、恶心(31.4%)。严重的不良反应(AE)(≥3级)发生率为47.3%。常见的有:①血液系统改变:血小板减少(1.6%)、贫血(1.0%)、白细胞减少(0.9%);②非血液系统改变:高血压(14.0%)、转氨酶异常(9.1%)、乏力(4.6%)。单药治疗后疾病完全缓解率(CR)为5.9%、部分缓解率(PR)为8.9%;疾病稳定(SD)39.7%;疾病进展(PD)的发生率45.5%,总体疾病控制率达到为54.5%。结论:FGFR1抑制剂使用后产生的副作用可耐受和调控。临床试验研究证实FGFR1抑制剂对部分实体瘤的治疗有一定疗效,期待进一步增加临床试验研究,通过改变给药剂量或/和考虑联合用药以提高其疗效。[关键词]FGFR1抑制剂;实体瘤;安全性;有效性;Meta分析SafetyandEfficacyofFGFR1InhibitorfortheTreatmentSolidTumors:AMetaAnalysisofClinicalTrialsLIUKai,WANGLi-ping,SUNFu-ting,etal(DepartmentofBloodTransfusion,WeifangPeople,sHospital,ShandongWeifang261041)[Abstract]Objective:TosystematicallyevaluatethesafetyandefficacyofFGFR1inhibitorsintreatmentofsolidtumorsreportedinclinicaltrials.Methods:PubMed,Embase,CochraneLibrary,Clinicaltrials,VIP,CNKIandWanfangdatabasesweresearchedtoscreenclinicaltrialreportsonFGFR1inhibitorsinthetreatmentofsoli...