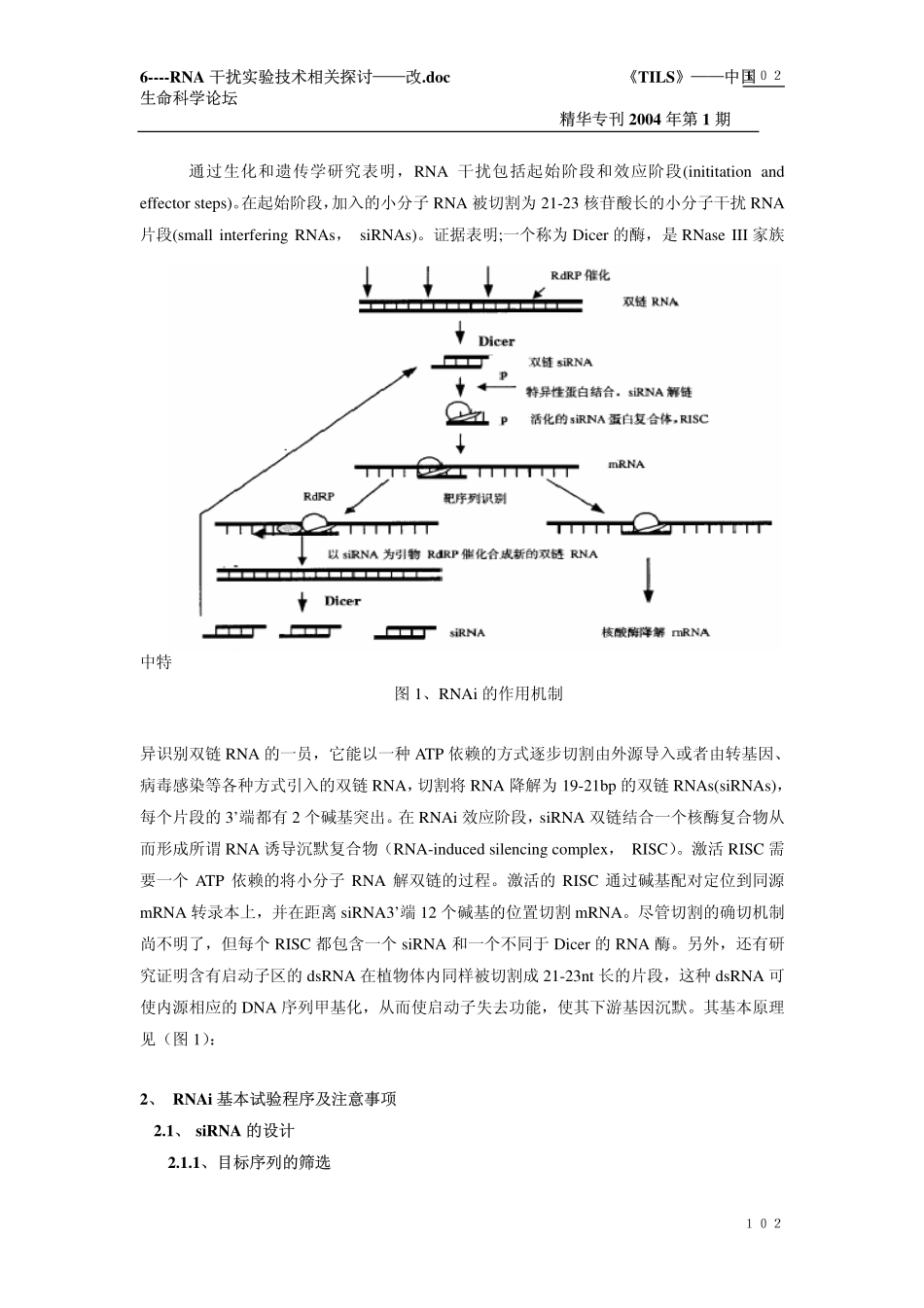
6----RNA干扰实验技术相关探讨——改.doc《TILS》——中国生命科学论坛精华专刊2004年第1期101101文章编号:06-(2004)063002101-10中图分类号:Q344中国生命科学论坛分子生物学版精华RNA干扰(RNAi)实验技术相关探讨马志杰(maziwise)编写小瘪修改(中国生命科学论坛分子生物学版第1版主)[责任编辑:TILS007]摘要:RNA干扰(RNAi)是一种由双链RNA所引起的序列特异性基因沉默。它是真核生物中基因转录后沉默作用的重要机制之一。RNAi技术作为新兴的基因阻抑方法,在功能基因组学、微生物学、基因表达调控机理研究等领域得到了广泛应用。本文就其作用机制、基本实验程序及注意事项作了较详细的综述,对其存在的相关问题和前景亦做了展望。关键词:RNAi;siRNA;转染小RNA作用与应用研究继2001,2002连续两年被美国Science杂志评为年度10大突破技术以来,近年来继续热度高涨,名列前矛。其核心技术RNA干扰(RNAi),即用20多个核苷酸组成的短的双链RNA(siRNA)代替传统反义核酸进行转录后基因沉默,已经迅速而广泛地应用到基因功能,基因表达调控机制研究等热门领域,不仅如此,它还为基因治疗开辟了新的途径。此外,RNAi沉默机制的探索也取得了相当的进展。目前,在大致勾画出生物体内源性小RNA的重要作用框架后,进一步阐述其作用细节、探索小RNA对细胞行为的调控、如何利用RNAi进行疾病防治等等都成为生物学家研究的一大热点。1、RNAi的作用机制6----RNA干扰实验技术相关探讨——改.doc《TILS》——中国生命科学论坛精华专刊2004年第1期102102通过生化和遗传学研究表明,RNA干扰包括起始阶段和效应阶段(inititationandeffectorsteps)。在起始阶段,加入的小分子RNA被切割为21-23核苷酸长的小分子干扰RNA片段(smallinterferingRNAs,siRNAs)。证据表明;一个称为Dicer的酶,是RNaseIII家族中特图1、RNAi的作用机制异识别双链RNA的一员,它能以一种ATP依赖的方式逐步切割由外源导入或者由转基因、病毒感染等各种方式引入的双链RNA,切割将RNA降解为19-21bp的双链RNAs(siRNAs),每个片段的3’端都有2个碱基突出。在RNAi效应阶段,siRNA双链结合一个核酶复合物从而形成所谓RNA诱导沉默复合物(RNA-inducedsilencingcomplex,RISC)。激活RISC需要一个ATP依赖的将小分子RNA解双链的过程。激活的RISC通过碱基配对定位到同源mRNA转录本上,并在距离siRNA3’端12个碱基的位置切割mRNA。尽管切割的确切机制尚不明了,但每个RISC都包含一个siRNA和...