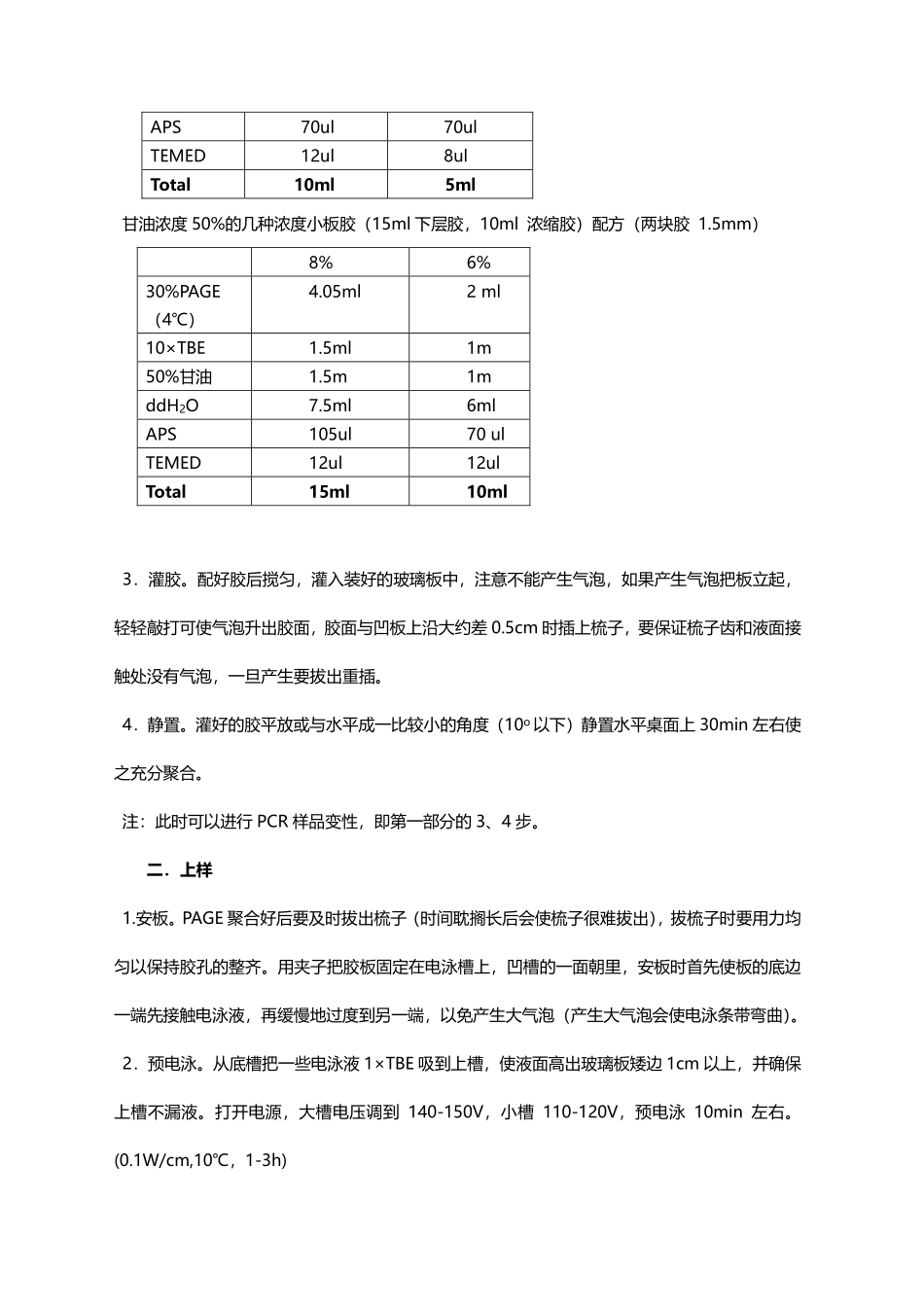
PCR-SSCP实验步骤一.样品制备1.PCR扩增并检测。根据不同的引物挑选适合的退火温度进行PCR扩增。扩增产物用2-2.5%的琼脂糖胶跑水平电泳检测,上样量3-5ul。PCR产物为10ng/nl左右为最佳。2.PCR产物与变性buffer混合。在干净的PCR管底部加入5ulSSCP上样缓冲液(变性缓冲液,同《分子克隆》中的测序缓冲液),然后在缓冲液中央加入PCR扩增产物。按照经验,扩增效果在琼脂糖胶上能看出比较亮的带的样品加1ul,效果很好加0.5ul,如果不太好就适当增加1.5、2或3不等,同时加大上样缓冲液的量,比如加3ul的PCR产物,缓冲液加到8ul变性效果更好。3.PCR产物变性。加好的样品进行离心,使样品集中在管底。PCR仪上95℃变性10分钟,立即取出PCR产物连同架子一同置于冰上静置5min,以免变性的产物复性。注:3和4步可以在制SSCP胶第四步后,等胶凝的过程中进行。二.制胶1.装板。在所要进行实验的每一副玻璃板先用自来水冲洗,然后使用ddH2O冲洗,然后使用吸水纸将玻璃板擦拭干,然后再玻璃板上涂抹无水酒精,待2-3min酒精挥发。将玻璃板组装好放入凝胶架子中,两边及底部固定好,两玻璃板保持水平,然后将发条拧紧。(可用无水乙醇测试是否漏胶)。2.配胶。甘油浓度50%的几种浓度大板胶(10ml下层胶,5ml浓缩胶)配方(两块胶1.0mm):8%6%30%PAGE2.7ml1ml10×TBE1ml0.5ml50%甘油1ml0.5mlddH2O5ml3mlAPS70ul70ulTEMED12ul8ulTotal10ml5ml甘油浓度50%的几种浓度小板胶(15ml下层胶,10ml浓缩胶)配方(两块胶1.5mm)8%6%30%PAGE(4℃)4.05ml2ml10×TBE1.5ml1m50%甘油1.5m1mddH2O7.5ml6mlAPS105ul70ulTEMED12ul12ulTotal15ml10ml3.灌胶。配好胶后搅匀,灌入装好的玻璃板中,注意不能产生气泡,如果产生气泡把板立起,轻轻敲打可使气泡升出胶面,胶面与凹板上沿大约差0.5cm时插上梳子,要保证梳子齿和液面接触处没有气泡,一旦产生要拔出重插。4.静置。灌好的胶平放或与水平成一比较小的角度(10o以下)静置水平桌面上30min左右使之充分聚合。注:此时可以进行PCR样品变性,即第一部分的3、4步。二.上样1.安板。PAGE聚合好后要及时拔出梳子(时间耽搁长后会使梳子很难拔出),拔梳子时要用力均匀以保持胶孔的整齐。用夹子把胶板固定在电泳槽上,凹槽的一面朝里,安板时首先使板的底边一端先接触电泳液,再缓慢地过度到另一端,以免产生大气泡(产生大气泡会使电泳条带弯曲)。2.预电泳。从底槽把一些电泳液1×TBE吸到上槽,使液面高出玻璃板矮边1cm以上,...