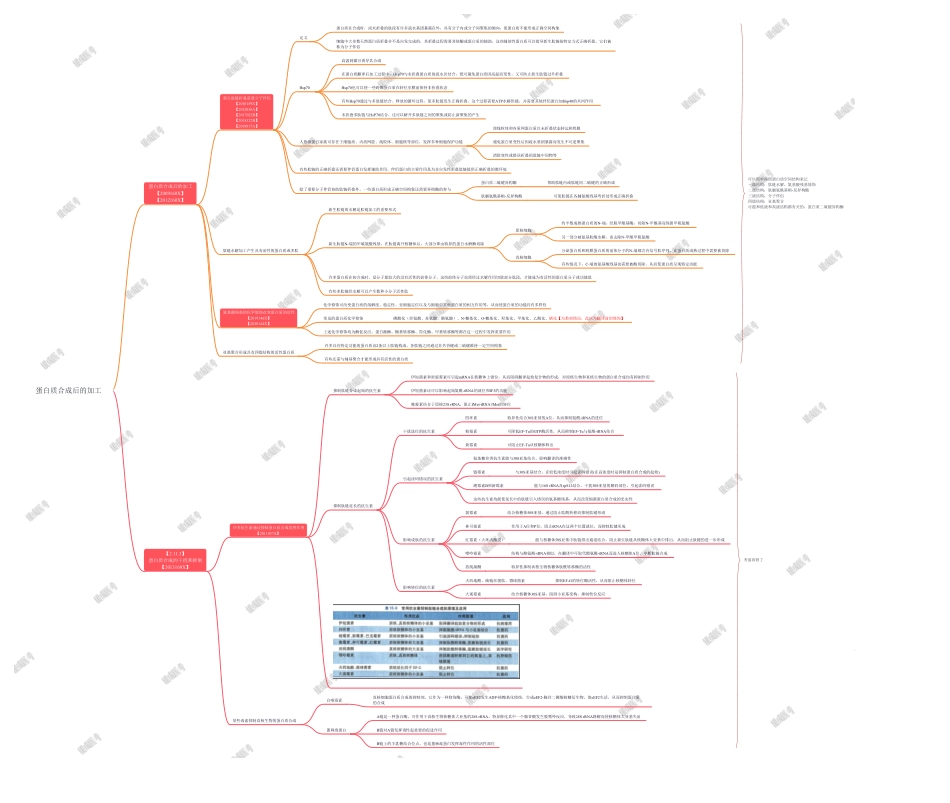
【2.11.3】蛋白质合成的干扰和抑制【2013160X】许多抗生素通过抑制蛋白质合成发挥作用【2011037A】抑制肽链合成起始的抗生素伊短菌素和密旋霉素可引起mRNA在核糖体上错位,从而阻碍翻译起始复合物的形成,对原核生物和真核生物的蛋白质合成均有抑制作用伊短菌素还可以影响起始氨酰-tRNA的就位和IF3的功能晚霉素结合于原核23SrRNA,阻止fMet-tRNAfMet的转位抑制肽链延长的抗生素干扰进位的抗生素四环素特异性结合30S亚基的A位,从而抑制氨酰-tRNA的进位粉霉素可降低EF-Tu的GTP酶活性,从而抑制EF-Tu与氨酰-tRNA结合黄霉素可阻止EF-Tu从核糖体释出引起读码错误的抗生素氨基糖苷类抗生素能与30S亚基结合,影响翻译的准确性链霉素与30S亚基结合,在较低浓度时引起读码错误(在高浓度时是抑制蛋白质合成的起始)潮霉素B和新霉素能与16SrRNA及rpS12结合,干扰30S亚基的解码部位,引起读码错误这些抗生素均能使延长中的肽链引入错误的氨基酸残基,从而改变细菌蛋白质合成的忠实性影响成肽的抗生素氯霉素结合核糖体50S亚基,通过阻止肽酰转移而抑制肽键形成林可霉素作用于A位和P位,阻止tRNA在这两个位置就位,而抑制肽键形成红霉素(大环内酯类)能与核糖体50S亚基中肽链排出通道结合,阻止新生肽链从核糖体大亚基中排出,从而阻止肽键的进一步形成嘌呤霉素结构与酪氨酰-tRNA相似,在翻译中可取代酪氨酰-tRNA而进入核糖体A位,中断肽链合成放线菌酮特异性抑制真核生物核糖体肽酰转移酶的活性影响转位的抗生素夫西地酸、硫链丝菌肽、微球菌素抑制EF-G的转位酶活性,从而阻止核糖体转位大观霉素结合核糖体30S亚基,阻碍小亚基变构,抑制转位反应某些毒素抑制真核生物的蛋白质合成白喉毒素真核细胞蛋白质合成的抑制剂,它作为一种修饰酶,可使eEF2发生ADP-核糖基化修饰,生成eEF2-腺苷二磷酸核糖衍生物,使eEF2失活,从而抑制蛋白质的合成蓖麻毒蛋白A链是一种蛋白酶,可作用于真核生物核糖体大亚基的28SrRNA,特异催化其中一个腺苷酸发生脱嘌呤反应,导致28SrRNA降解而使核糖体大亚基失活B链对A链发挥毒性起重要的促进作用B链上的半乳糖结合位点,也是蓖麻毒蛋白发挥毒性作用的活性部位蛋白质合成后的加工【2009160X】【2012160X】新生肽链折叠需要分子伴侣【2010159X】【2012036A】【2017025B】【2018122B】【2019017A】定义蛋白质在合成时,尚未折叠的肽段有许多疏水基团暴露在外,具有分子内或分子间聚集的倾向,使蛋白质不能形成正确空间构象细胞中大多数天...