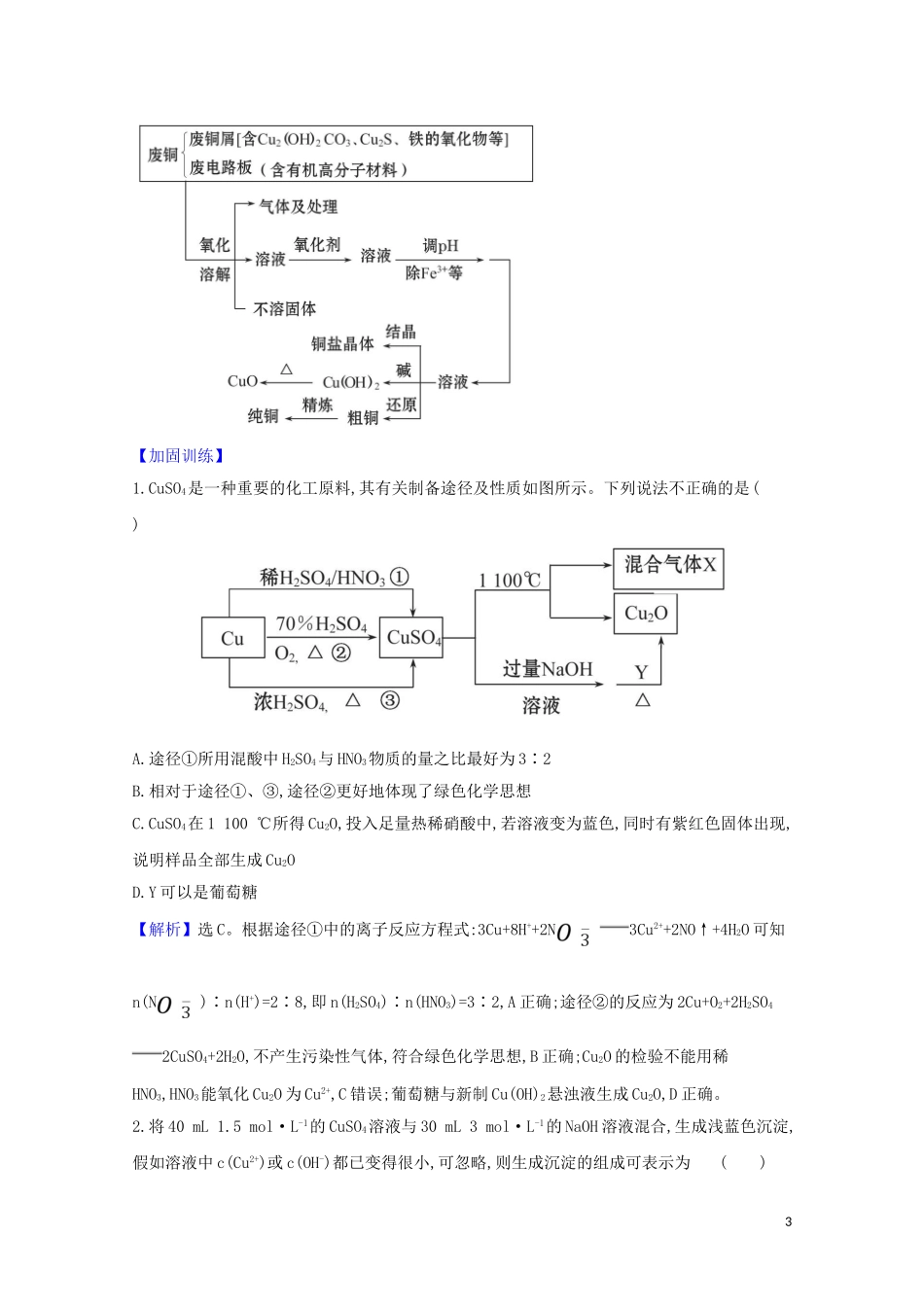
用途广泛的金属材料和开发利用金属矿物1.某同学通过如下流程制备氧化亚铜:已知:CuCl难溶于水和稀硫酸;Cu2O+2H+Cu2++Cu+H2O。下列说法不正确的是()A.步骤②SO2可用Na2SO3替换B.步骤③中为防止CuCl被氧化,可用SO2水溶液洗涤C.步骤④发生反应的离子方程式为2CuCl+2OH-Cu2O+2Cl-+H2OD.如果Cu2O试样中混有CuCl和CuO杂质,用足量稀硫酸与Cu2O试样充分反应,根据反应前、后固体质量可计算试样纯度【解析】选D。步骤②SO2可用Na2SO3替换,反应为2Cl-+2Cu2++S+H2O2CuCl↓+S+2H+,A正确;用SO2水溶液洗涤CuCl可防止步骤③中CuCl被氧化,B正确;步骤④发生反应的离子方程式为2CuCl+2OH-Cu2O+2Cl-+H2O,C正确;如果Cu2O试样中混有CuCl和CuO杂质,用足量稀硫酸与Cu2O试样充分反应,发生的反应有Cu2O+2H+Cu2++Cu+H2O、CuO+2H+Cu2++H2O,CuCl...