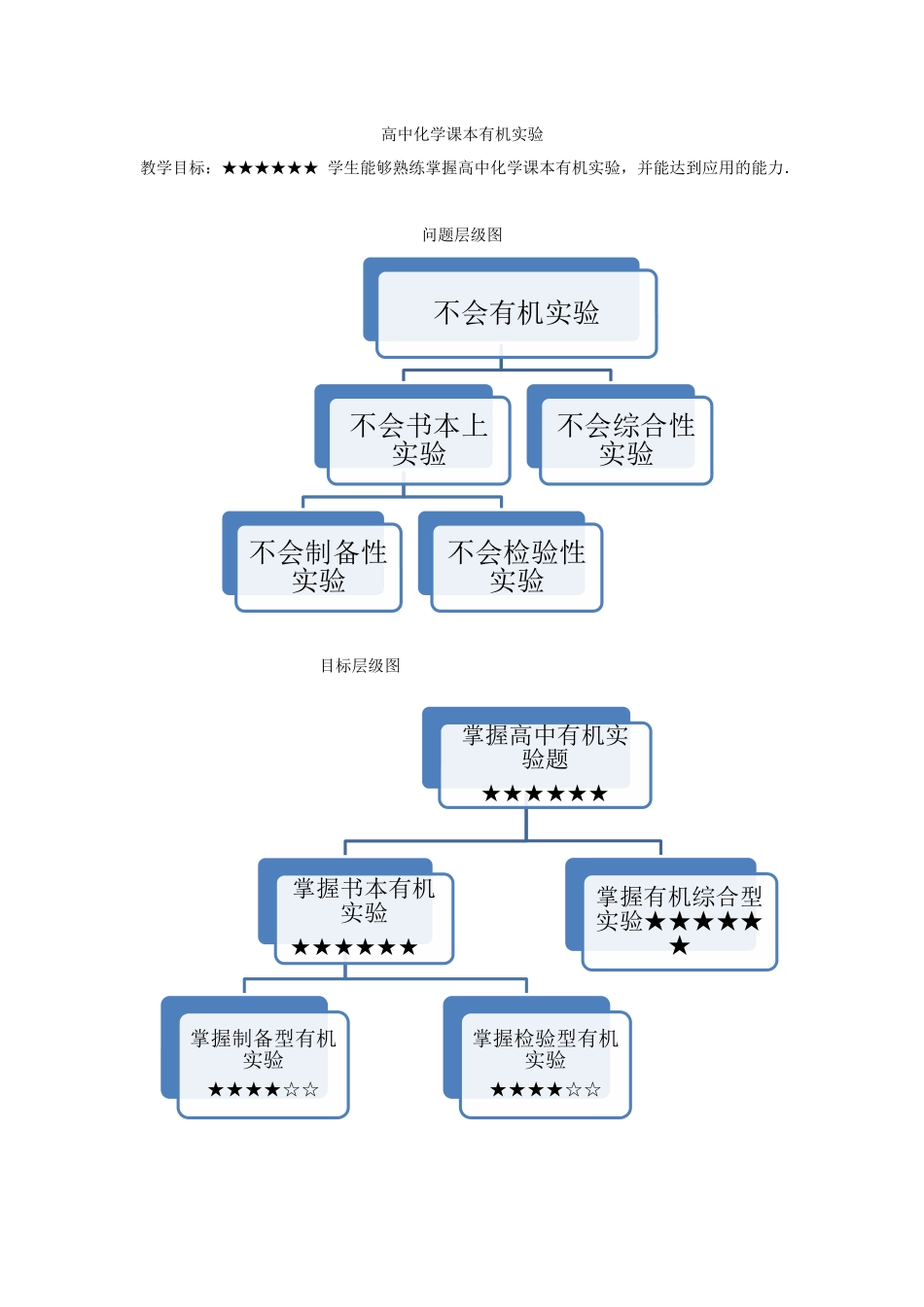
高中化学课本有机实验教学目标:★★★★★★学生能够熟练掌握高中化学课本有机实验,并能达到应用的能力.问题层级图目标层级图不会有机实验不会书本上实验不会制备性实验不会检验性实验不会综合性实验掌握高中有机实验题★★★★★★掌握书本有机实验★★★★★★掌握制备型有机实验★★★★☆☆掌握检验型有机实验★★★★☆☆掌握有机综合型实验★★★★★★高中化学有机实验一、掌握选修5课本实验(一)、掌握有机物制备的实验(★★★★☆☆)1.甲烷的氯代(必修2、P56)(性质)实验:取一个100mL的大量筒(或集气瓶),用排水的方法先后收集20mLCH4和80mLCl2,放在光亮的地方(注意:不要放在阳光直射的地方,以免引起爆炸),等待片刻,观察发生的现象。现象:大约3min后,可观察到混合气体颜色变浅,气体体积缩小,量筒壁上出现油状液体,量筒内饱和食盐水液面上升,可能有晶体析出。2.乙烯的实验室制法:(1)反应原料:乙醇、浓硫酸(2)反应原理:CH3CH2OHCH2=CH2↑+H2O副反应:2CH3CH2OHCH3CH2OCH2CH3+H2OC2H5OH+6H2SO4(浓)6SO2↑+2CO2↑+9H2O现象:乙烯使KMnO4酸性溶液褪色(氧化反应)(检验)(3)浓硫酸:催化剂和脱水剂(混合时即将浓硫酸沿容器内壁慢慢倒入已盛在容器内的无水酒精中,并用玻璃棒不断搅拌)(4)碎瓷片,以防液体受热时爆沸;石棉网加热,以防烧瓶炸裂。(5)实验中要通过加热使无水酒精和浓硫酸混合物的温度迅速上升到并稳定于170℃左右。(不能用水浴)(6)温度计要选用量程在200℃~300℃之间的为宜。温度计的水银球要置于反应物的中央位置,因为需要测量的是反应物的温度。(7)实验结束时,要先将导气管从水中取出,再熄灭酒精灯,反之,会导致水被倒吸。(8)乙烯的收集方法不能用排空气法,否则会爆炸(9)点燃乙烯前要_验纯。(10)在制取乙烯的反应中,浓硫酸不但是催化剂、吸水剂,也是氧化剂,在反应过程中易将乙醇氧化,最后生成CO2、CO、C等(因此试管中液体变黑),而硫酸本身被还原成SO2。故乙烯中混有_SO2、CO2。(11)必须注意乙醇和浓硫酸的比例为1:3,且需要的量不要太多,否则反应物升温太慢,副反应较多,从而影响了乙烯的产率。使用过量的浓硫酸可提高乙醇的利用率,增加乙烯的产量。3、乙炔的实验室制法:(1)反应方程式:CaC2+2H2O→C2H2↑+Ca(OH)2(注意不需要加热)(2)发生装置:固液不加热(不能用启普发生器)(3)得到平稳的乙炔气流:①常用饱和氯化钠溶液代替水(减小浓度...