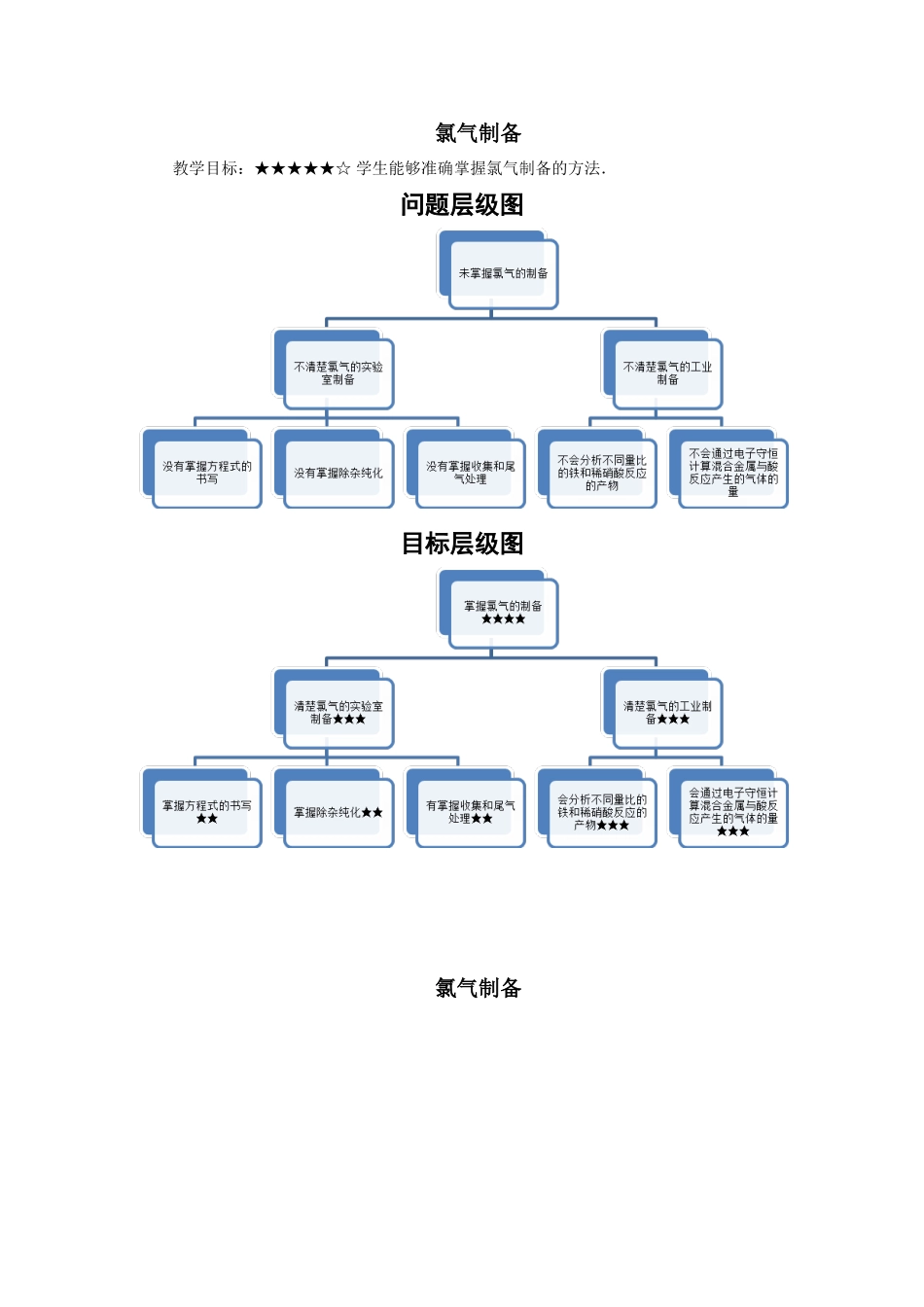
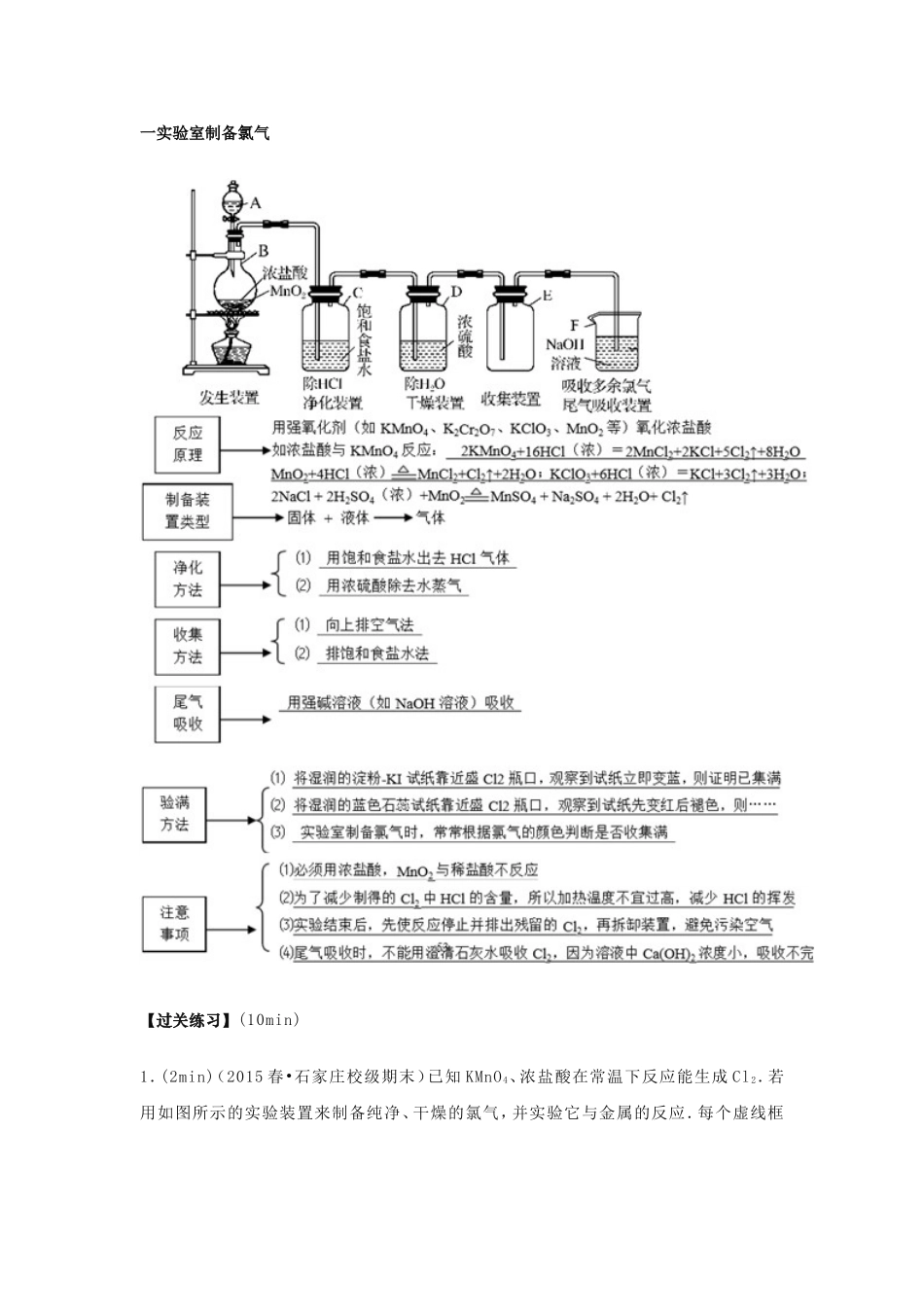
氯气制备教学目标:★★★★★☆学生能够准确掌握氯气制备的方法.问题层级图目标层级图氯气制备一实验室制备氯气【过关练习】(10min)1.(2min)(2015春•石家庄校级期末)已知KMnO4、浓盐酸在常温下反应能生成Cl2.若用如图所示的实验装置来制备纯净、干燥的氯气,并实验它与金属的反应.每个虚线框表示一个单元装置,其中有错误的是()A.①和②处B.②处C.②和③处D.②③④处2(2min)下列关于实验室制取氯气的说法正确的是()A.盛浓盐酸的分液漏斗可用长颈漏斗代替B.为了便于学生观察氯气的制备实验,可在讲台上直接做氯气的制备实验C.可用饱和食盐水吸收尾气D.可在集气瓶口放一张湿润的淀粉碘化钾试纸,观察氯气是否收集满3(1.5min)实验室用下列两种方法制氯气:①用含HCl146g的浓盐酸与足量的MnO2反应;②用87gMnO2与足量浓盐酸反应.所得的氯气()A.①比②多B.②比①多C.一样多D.无法比较4(1.5min)实验室制Cl2时有如下操作:①连好装置,检查器密性;②缓缓加热;③加入MnO2粉末;④从装有浓盐酸的分液漏斗中加入浓盐酸;⑤将多余氯气用NaOH溶液吸收;⑥用向上排气收集氯气.顺序正确的是()A.①②③④⑥⑤B.③④②①⑥⑤C.①④③②⑥⑤D.①③④②⑥⑤二工业制备氯气:2NaCl+2H2OH2↑+Cl2↑+2NaOH【过关练习】(10min)1.氯碱工业中电解饱和食盐水的原理示意图如右图所示通电(1)溶液A的溶质是;(2)电解饱和食盐水的离子方程式是(3)电解时用盐酸控制阳极区溶液的PH在2~3,用化学平衡移动原理解释盐酸的作用:(4)电解所用的盐水需精制。去除有影响的Ca2+、Mg2+,NH3,SO42-,[C(SO42-)>C(Ca2+)]精致流程如下(淡盐水和溶液A来电解池):①盐泥a除泥沙外,还含有的物质是。②过程Ⅰ中将NH4+转化为N2的离子方程式是③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有④经过程Ⅲ处理,要求盐水中c中剩余Na2SO3的含量小于5mg/L,若盐水b中NaClO的含量是7.45mg/L,则处理10m3盐水b,至多添加10%Na2SO3溶液kg(溶液体积变化忽略不计)。【单元过关练习】补救填空(15s)1.工业上用电解饱和溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业.2(2min)NaCI是一种化工原料,可以制备一系列物质(如图所示),下列说法正确的是()A.常温干燥的Cl2能用钢瓶储存,所以Cl2不与铁反应B.工业上利用澄清石灰水与Cl2反应来制漂白粉C.往NaCl溶液中先通足量氨气后,再通入足量CO2才可能析出NaHCO3D...