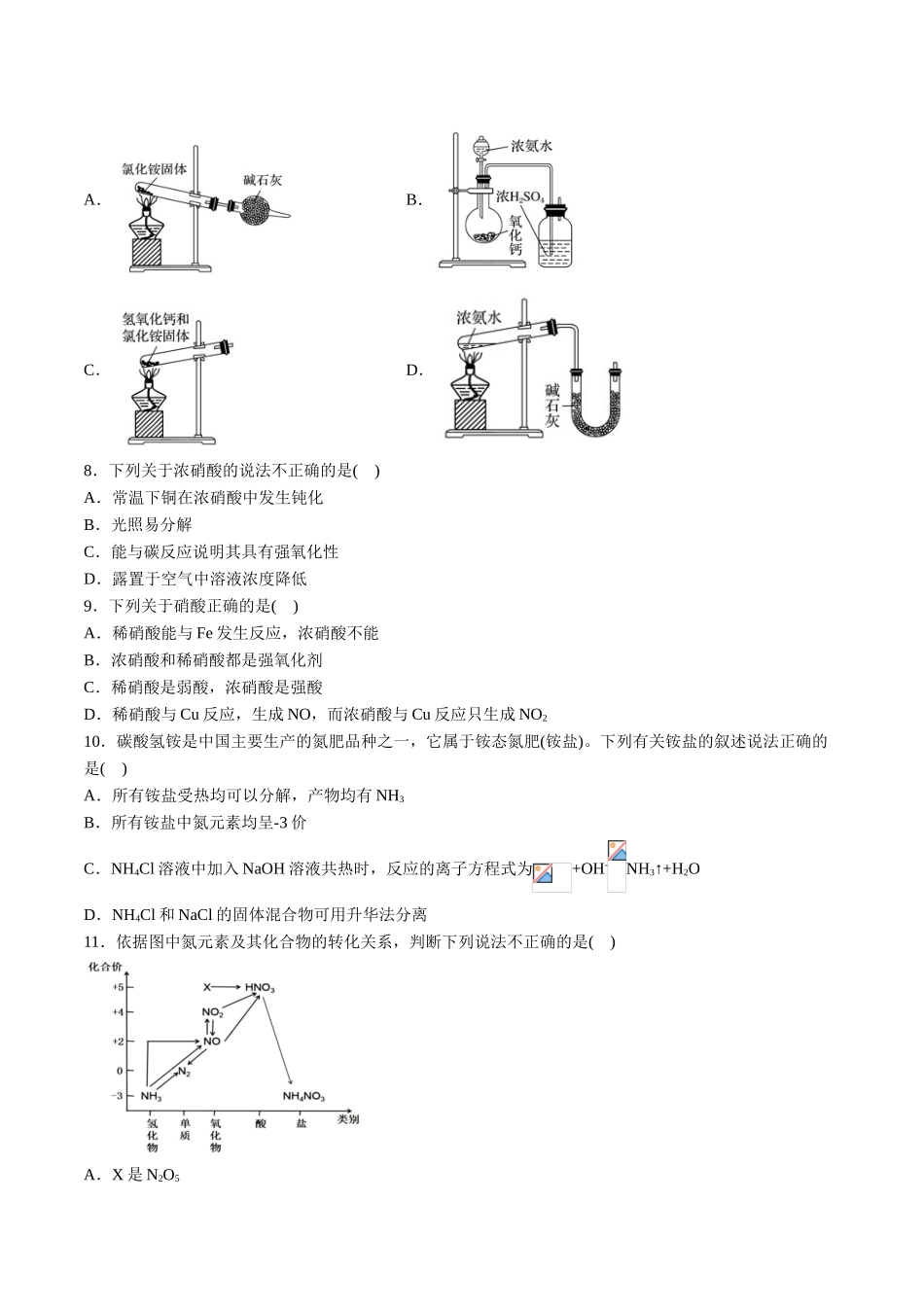
专题02氮及其化合物专项训练1.下列用途中应用了氮气的稳定性的是:()A.以氮气为原料之一制造硝酸B.合成氨气后,制氮肥C.金属焊接时的保护气D.镁可以和氮气反应2.下列关于氮及其化合物,说法不正确的是()A.氮的固定是将N2转化成含氮化合物B.氮元素在自然界中既有游离态又有化合态C.NO和NO2都可稳定存在于空气中D.N2既可作氧化剂又可做还原剂3.下列叙述正确的是()A.液氨用作制冷剂发生的是化学反应B.氨气溶水得到氨水发生的只是物理变化C.分离液态空气制取氮气属于氮的固定D.氮气与氢气化合生成氨气属于人工固氮4.酸雨被称为“天堂的眼泪”,会造成水土酸性化、建筑物加速腐蚀等危害。下列说法正确的是()A.酸雨不会对动植物产生任何影响B.使用新型能源不会对酸雨的防治产生效果C.酸雨指的是pH小于7的雨水D.NO2和SO2的过度排放是形成酸雨的主要原因5.目前,我国是世界三大酸雨区之一,治理酸雨对我国的可持续发展有着重大意义,下列有关酸雨的说法错误的是A.开发能替代化石能源的新能源,如氢能、太阳能等B.利用石灰石对含硫燃料进行脱硫处理C.空气质量指数(AQI)监测SO2、NO2、PM2.5、PM10、O3、CO2检测项目D.利用熟石灰处理酸化土壤6.下列说法正确的是()A.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在B.NH3汽化时吸收大量的热,因此,氨常用作制冷剂C.CO2、NO2或SO2都会导致酸雨的形成D.活性炭、SO2、Na2O2都能使品红溶液褪色,原理相同7.下面是实验室制取氨气的装置和选用的试剂,其中正确的是A.B.C.D.8.下列关于浓硝酸的说法不正确的是()A.常温下铜在浓硝酸中发生钝化B.光照易分解C.能与碳反应说明其具有强氧化性D.露置于空气中溶液浓度降低9.下列关于硝酸正确的是()A.稀硝酸能与Fe发生反应,浓硝酸不能B.浓硝酸和稀硝酸都是强氧化剂C.稀硝酸是弱酸,浓硝酸是强酸D.稀硝酸与Cu反应,生成NO,而浓硝酸与Cu反应只生成NO210.碳酸氢铵是中国主要生产的氮肥品种之一,它属于铵态氮肥(铵盐)。下列有关铵盐的叙述说法正确的是()A.所有铵盐受热均可以分解,产物均有NH3B.所有铵盐中氮元素均呈-3价C.NH4Cl溶液中加入NaOH溶液共热时,反应的离子方程式为+OH-NH3↑+H2OD.NH4Cl和NaCl的固体混合物可用升华法分离11.依据图中氮元素及其化合物的转化关系,判断下列说法不正确的是()A.X是N2O5B.工业上以NH3、空气、水为原料生产硝酸C.可用排空气法收集NO气体D.由NH3→N2,从原理上看,NH3可与N...