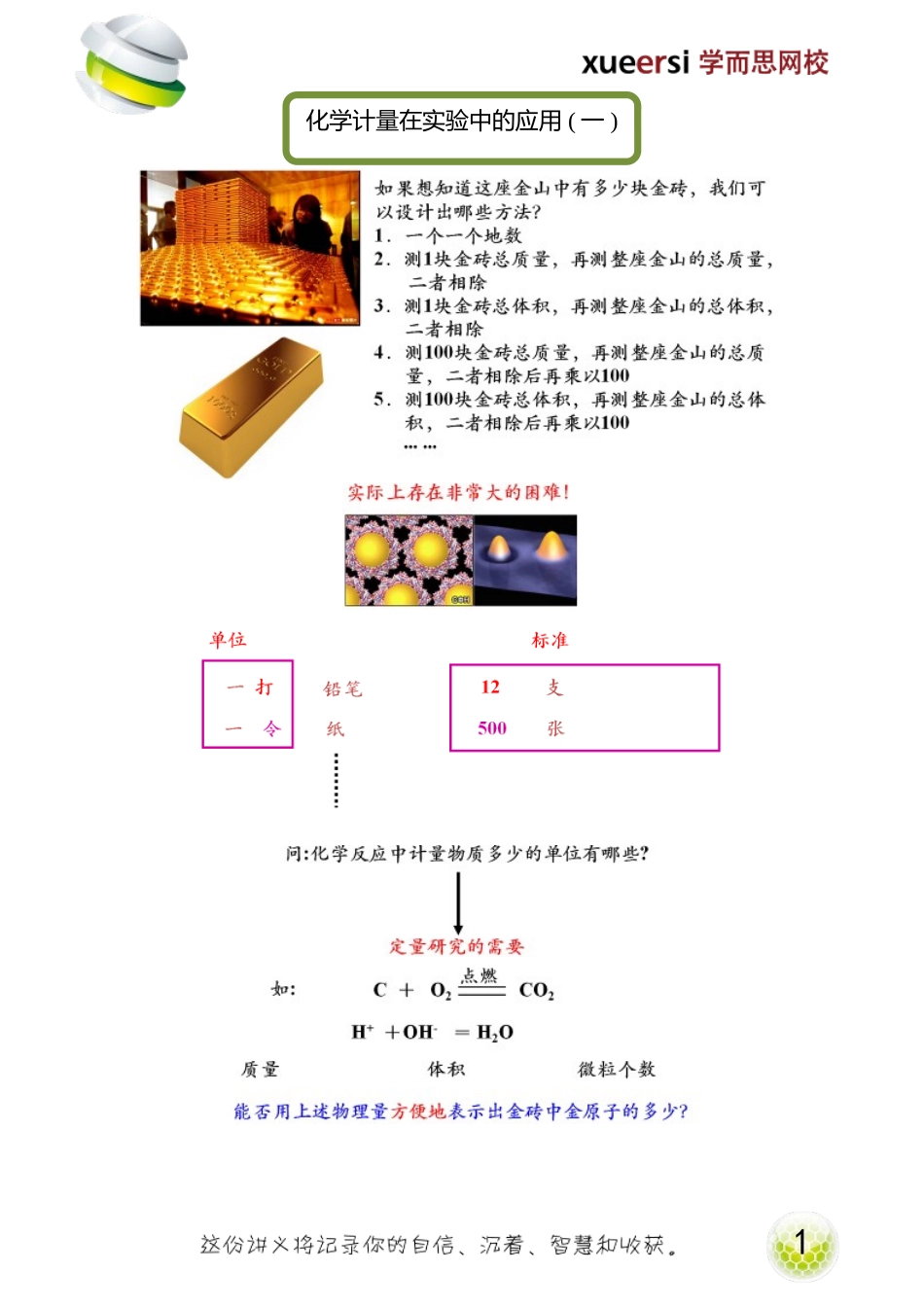
1化学计量在实验中的应用(一)2思考:曹冲称象成功案例:因为大象质量大、体积大,不易称量,所以要将大象的质量或体积“化整为零”,利用“零”来测量“整”。启示:测量金砖中金原子的数目,因为单个金原子的质量、体积等太小而极不易测量,但大量金原子“堆积”为宏观物体时,质量、体积等物理量相对就容易测量了。所以我们可以考虑“化零为整”。以上两种方法,均利用了“间接测量”的思想。国际规定:以0.012千克12C所含的碳原子数为标准(阿伏加德罗常数约为6.02×1023)------1摩尔任何约含有6.02×1023个粒子的微粒集合体都称为1mol物质的量1.物质的量概念:是用来解决宏观物质和微观粒子之间关系问题的,表示含有一定数目粒子的集体的物理量。a.是七个国际基本物理量之一b.是一个专有名词,由固定字数组成,不能分割、不能增减。c.符号为“n”d.微粒是指:分子、原子、离子、中子及特定组合等e.粒子必须十分明确,且用化学式表示2.摩尔⑴概念:是物质的量的单位,简称摩。⑵符号:mol⑶基准:每摩尔物质中约含有6.02×1023个微粒阿伏加德罗常数(原意):以12g12C中所含的原子数目为标准的,也就是说,如果在一定量的粒子集体中所含有的粒子数与12g12C中所含的碳原子数目相同,则它的物质的量为1mol,而这个数值(粒子数)就叫阿伏加德罗常数⑷数值:阿佛加德罗常数,用NA表示。⑸规定:1mol任何粒子的粒子数叫做阿佛加德罗常数。⑹近似值:6.02×1023⑺物质的量、阿佛加德罗常数与粒子数(符号为N)之间的关系:3使用摩尔时应注意:摩尔是物质的量的单位,1摩尔任何物质含有阿佛加德罗常数(NA)个微粒。⑴摩尔这一单位,通常用来表示原子、分子、离子、电子等特定对象。不能用来表示如1mol人等,摩尔定义中的每摩尔物质,通常指某种微粒。⑵使用摩尔时,微粒的名称应予以指出,通常是将微粒的符号写在摩尔名称或符号的后面。6.02×1023究竟有多大?⑴若把6.02×1023个鸡蛋分给十亿人,每人每天平均吃3个鸡蛋,一年按365天计算,能吃(5500)亿年。⑵如果把6.02×1023粒米给全球60亿人吃,每人每天吃一斤,要吃14万年⑶已知地球赤道的周长约为4万公里,一个分子的直径约为2×10-10m。假想把1mol分子一个挨一个地摆在地球的赤道上,可以绕地球赤道(301)万周。⑷如果把6.02×1023个直径为2.5cm的硬币排成一行,可以来回于地球与太阳之间240.8亿次【例1】判断下列说法是否正确(A)1摩尔氧(B)1摩尔氧原子(C)2摩尔分子氢(D)3摩尔水(E)0.5摩二氧化碳【...