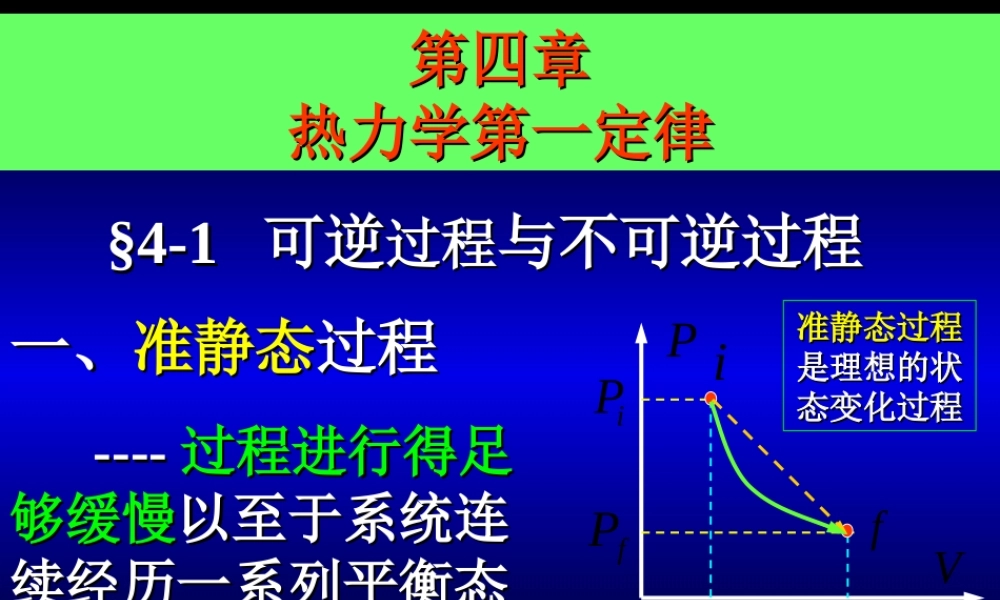
系统的系统的弛豫时间弛豫时间>>外界变化所需的时间外界变化所需的时间§4-1§4-1可逆可逆过程过程与不可逆过程与不可逆过程第四章第四章热力学第一定律热力学第一定律一、一、准静态准静态过程过程PViPiVifPfVf--------过程过程进行得足进行得足够缓慢够缓慢以至于系统连以至于系统连续经历一系列平衡态续经历一系列平衡态系统的系统的弛豫时间弛豫时间<<外界变化所需的时间外界变化所需的时间准静态过程准静态过程是理想的状是理想的状态变化过程态变化过程系统的系统的弛豫时间弛豫时间>>外界变化所需的时间外界变化所需的时间二、二、可逆过程可逆过程与与不可逆过程不可逆过程若一个过程发生后可以沿原过程反若一个过程发生后可以沿原过程反向进行,并使向进行,并使系统和外界都再回到它们系统和外界都再回到它们的初态的初态,则该过程称为,则该过程称为可逆过程可逆过程11、过程可逆的条件、过程可逆的条件无耗散的准静态过程是无耗散的准静态过程是可逆可逆过程过程系统内各部以及系统与外界之间同时满系统内各部以及系统与外界之间同时满足足热力学平衡条件热力学平衡条件所有所有与热有关与热有关的的自发过程自发过程都是都是不可逆不可逆的的无耗散无耗散准静态准静态22、过程不可逆的诸情形、过程不可逆的诸情形aa、、功热转换功热转换不可逆不可逆功可以功可以自动地自动地转变为热,热转变为热,热不能自不能自动地动地转变为功转变为功bb、、热传导热传导不可逆不可逆热量从高温物体传向低温物体的过程热量从高温物体传向低温物体的过程是不可逆的是不可逆的--------存在耗散存在耗散--------不满足不满足热学平衡条件热学平衡条件cc、、气体自由膨胀气体自由膨胀不可逆不可逆--------不满足不满足力学平衡条件力学平衡条件dd、、扩散扩散、、溶解溶解以及以及自发的化自发的化学反应学反应不可逆不可逆--------不满足不满足化学平衡条件化学平衡条件ee、一切、一切生命过程生命过程不可逆不可逆--------时间箭头时间箭头是是确定的确定的参阅参阅pp227227§4-2§4-2功和热量功和热量一、一、功功是力学作用下的能量转移是力学作用下的能量转移如果系统状态的变化起因于力学平衡如果系统状态的变化起因于力学平衡被破坏,则称被破坏,则称系统与外界系统与外界存在存在力学作用力学作用11、、功功不是状态参量,不是状态参量,与具体过程有关与具体过程有关说明:说明:22、、热学热学中,计算系统对外做功一般局中,计算系统对...