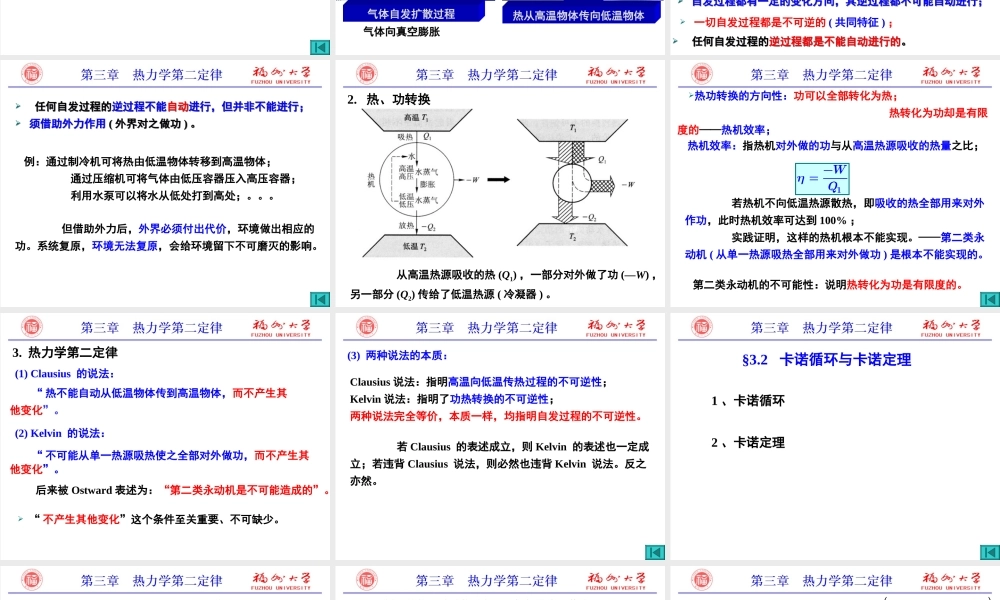
第三章不可能把热从低温物体传到高温物体,而不引起其它变化。引言违背热力学第一定律的变化与过程一定不能发生;不违背热力学第一定律变化或过程却未必能自动发生。大量实践经验指出,自然界中一切自动进行的变化都有确定的方向,不可能自动逆转;热力学第一定律:只解决过程中系统与环境间的能量交换问题;无法指出变化的方向和限度。热力学第二定律:解决过程的方向与限度的判断问题。热力学第二定律是人类长期生产、生活实践经验的总结;反过来,它指导生产实践活动;热力学第二定律关于某过程不能发生的断言是十分肯定的;而关于某过程可能发生的断言则仅指有发生的可能性,它不涉及速率问题。§3.1热力学第二定律§3.2卡诺循环与卡诺定理§3.3熵与克劳修斯不等式§3.4熵变的计算§3.5热力学第三定律及化学变化过程熵变的计算§3.6亥姆霍兹函数和吉布斯函数§3.7热力学基本方程及麦克斯韦关系式§3.8热力学第二定律在单组分系统相平衡中的应用本章小结第三章热力学第二定律§3.1热力学第二定律1、自发过程2、热、功转换3、热力学第二定律1.自发过程§3.1热力学第二定律气体自发扩散过程气体向真空膨胀热从高温物体传向低温物体自发过程:在自然条件下(不需外力帮助)能够自动发生的过程;非自发过程:自发过程的逆过程;锌置换硫酸铜中的铜:Zn+Cu2+=Zn2++Cu一切自发过程都是不可逆的(共同特征);水从高处流向低处;铁在潮湿的空气中锈蚀;浓度不等的溶液混合均匀;自发过程都有一定的变化方向,其逆过程都不可能自动进行;自发过程都有一定的变化方向,其逆过程都不可能自动进行;任何自发过程的逆过程都是不能自动进行的。任何自发过程的逆过程都是不能自动进行的。但借助外力后,外界必须付出代价,环境做出相应的功。系统复原,环境无法复原,会给环境留下不可磨灭的影响。例:通过制冷机可将热由低温物体转移到高温物体;通过压缩机可将气体由低压容器压入高压容器;利用水泵可以将水从低处打到高处;。。。任何自发过程的逆过程不能自动进行,但并非不能进行;须借助外力作用(外界对之做功)。任何自发过程的逆过程不能自动进行,但并非不能进行;须借助外力作用(外界对之做功)。2.热、功转换从高温热源吸收的热(Q1),一部分对外做了功(—W),另一部分(Q2)传给了低温热源(冷凝器)。热机效率:指热机对外做的功与从高温热源吸收的热量之比;若热机不向低温热源散热,即吸收的热全部用来对外作功,此时热机效率可...