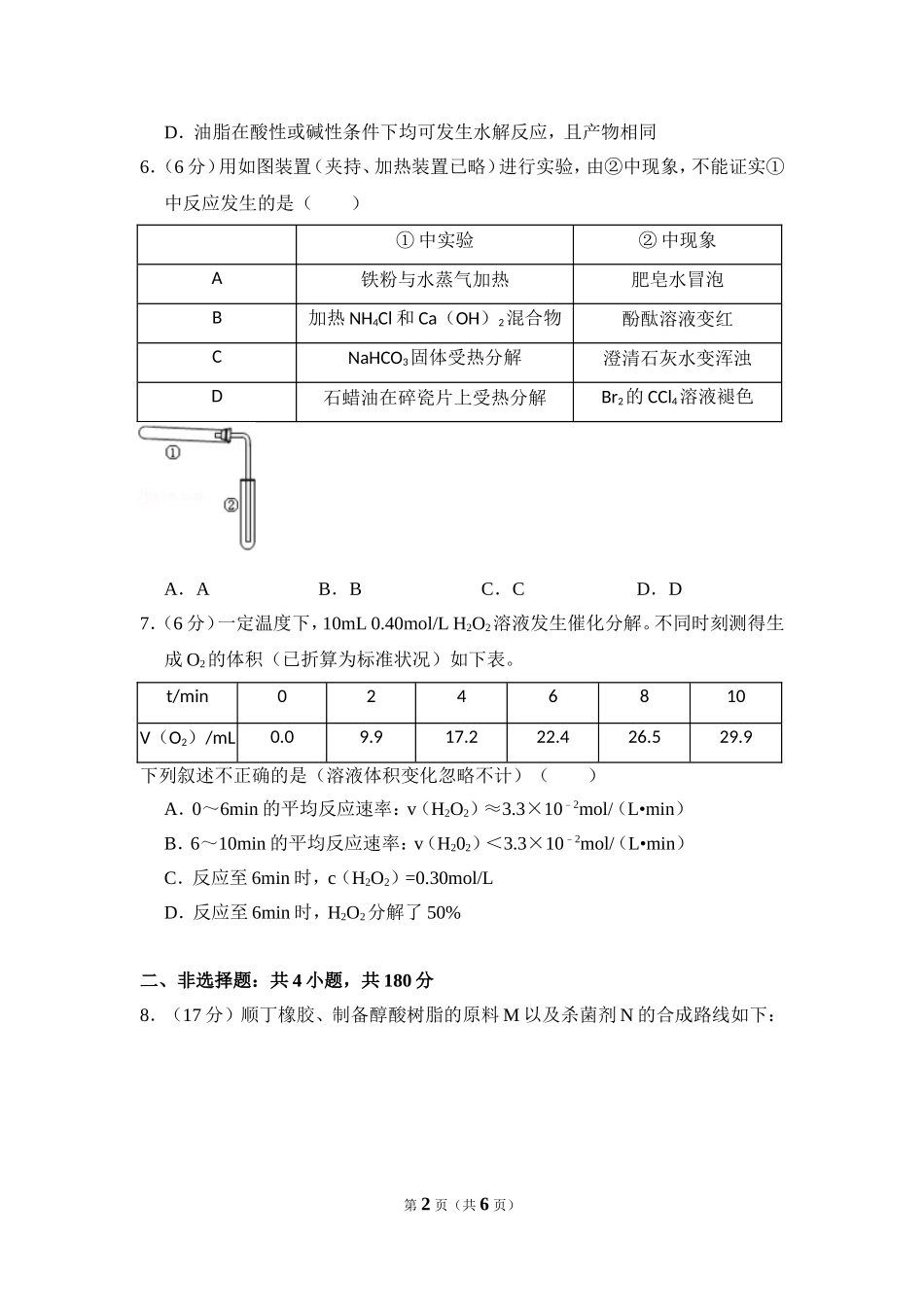
2014年北京市高考化学试卷一、选择题:共7小题,每小题6分,共120分.在每小题给出的四个选项中,选出最符合题目要求的一项.1.(6分)下列试剂中,标签上应标注和的是()A.C2H5OHB.HNO3C.NaOHD.HCl2.(6分)下列金属中,表面自然形成的氧化层能保护内层金属不被空气氧化的是()A.KB.NaC.FeD.Al3.(6分)下列电池工作时,O2在正极放电的是()A.锌锰电池B.氢燃料电池C.铅蓄电池D.镍镉电池4.(6分)下列解释事实的方程式不正确的是()A.测0.1mol/L氨水的pH为11:NH3•H2O⇌NH4++OH﹣B.将Na块放入水中,产生气体:2Na+2H2O═2NaOH+H2↑C.用CuCl2溶液做导电实验,灯泡发光:CuCl2Cu2++2Cl﹣D.Al片溶于NaOH溶液中,产生气体:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑5.(6分)下列说法正确的是()A.室温下,在水中的溶解度:丙三醇>苯酚>1﹣氯丁烷B.用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3C.用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3第1页(共6页)D.油脂在酸性或碱性条件下均可发生水解反应,且产物相同6.(6分)用如图装置(夹持、加热装置已略)进行实验,由②中现象,不能证实①中反应发生的是()①中实验②中现象A铁粉与水蒸气加热肥皂水冒泡B加热NH4Cl和Ca(OH)2混合物酚酞溶液变红CNaHCO3固体受热分解澄清石灰水变浑浊D石蜡油在碎瓷片上受热分解Br2的CCl4溶液褪色A.AB.BC.CD.D7.(6分)一定温度下,10mL0.40mol/LH2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。t/min0246810V(O2)/mL0.09.917.222.426.529.9下列叙述不正确的是(溶液体积变化忽略不计)()A.0~6min的平均反应速率:v(H2O2)≈3.3×102﹣mol/(L•min)B.6~10min的平均反应速率:v(H202)<3.3×102﹣mol/(L•min)C.反应至6min时,c(H2O2)=0.30mol/LD.反应至6min时,H2O2分解了50%二、非选择题:共4小题,共180分8.(17分)顺丁橡胶、制备醇酸树脂的原料M以及杀菌剂N的合成路线如下:第2页(共6页)已知:i.ⅱ.RCH=CHR′RCHO+R′CHO(R、R′代表烃基或氢)(1)CH2=CHCH=CH﹣2的名称是.(2)反应Ⅰ的反应类型是(选填字母).a、加聚反应b、缩聚反应(3)顺式聚合物P的结构式是(选填字母).(4)A的相对分子质量为108.①反应Ⅱ的化学方程式是.②1molB完全转化成M所消耗H2的质量是g.(5)反应Ⅲ的化学方程式是.(6)A的某些同分异构体在相同的反应条件下也能生成B和C,写出其中一种同...