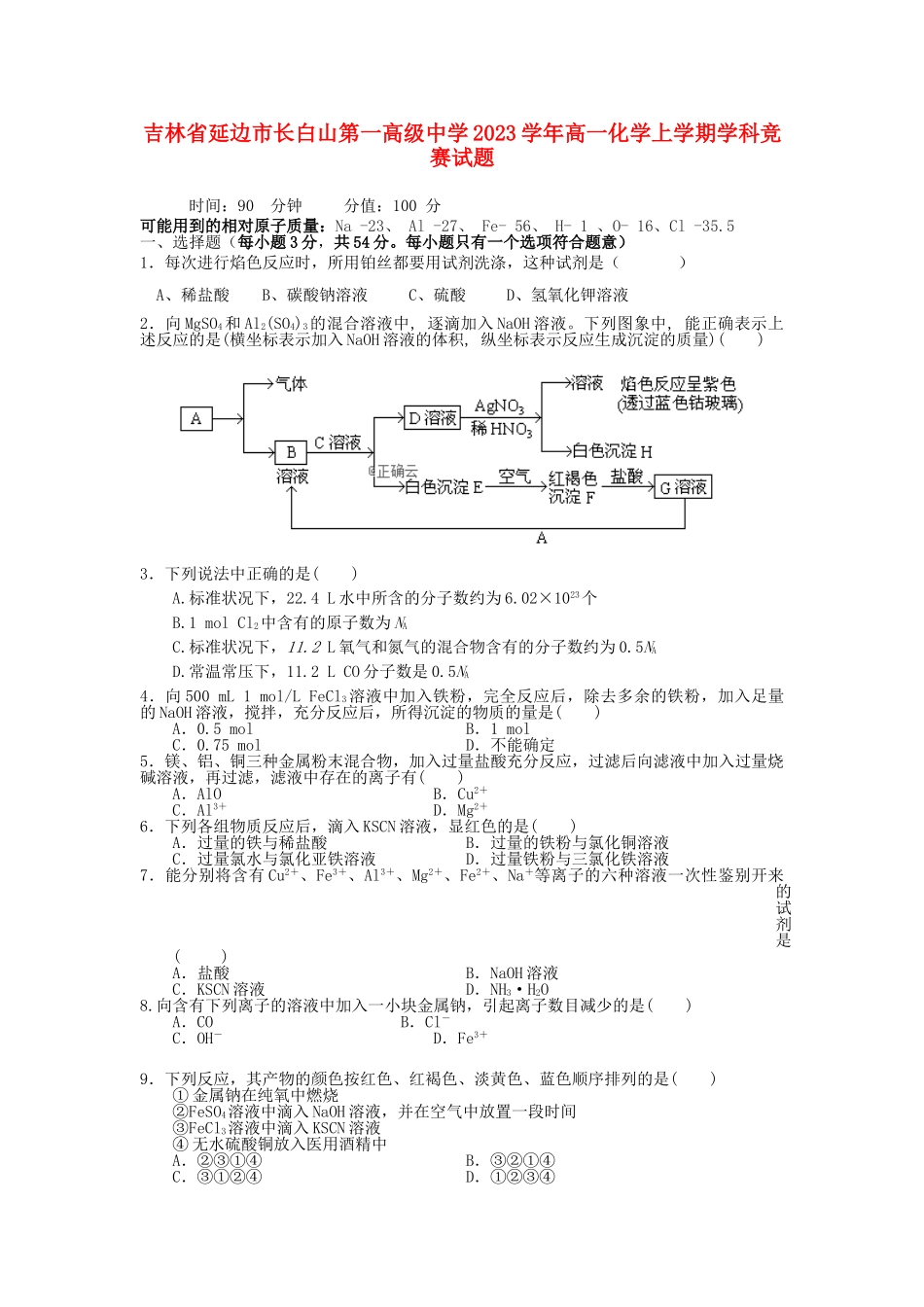
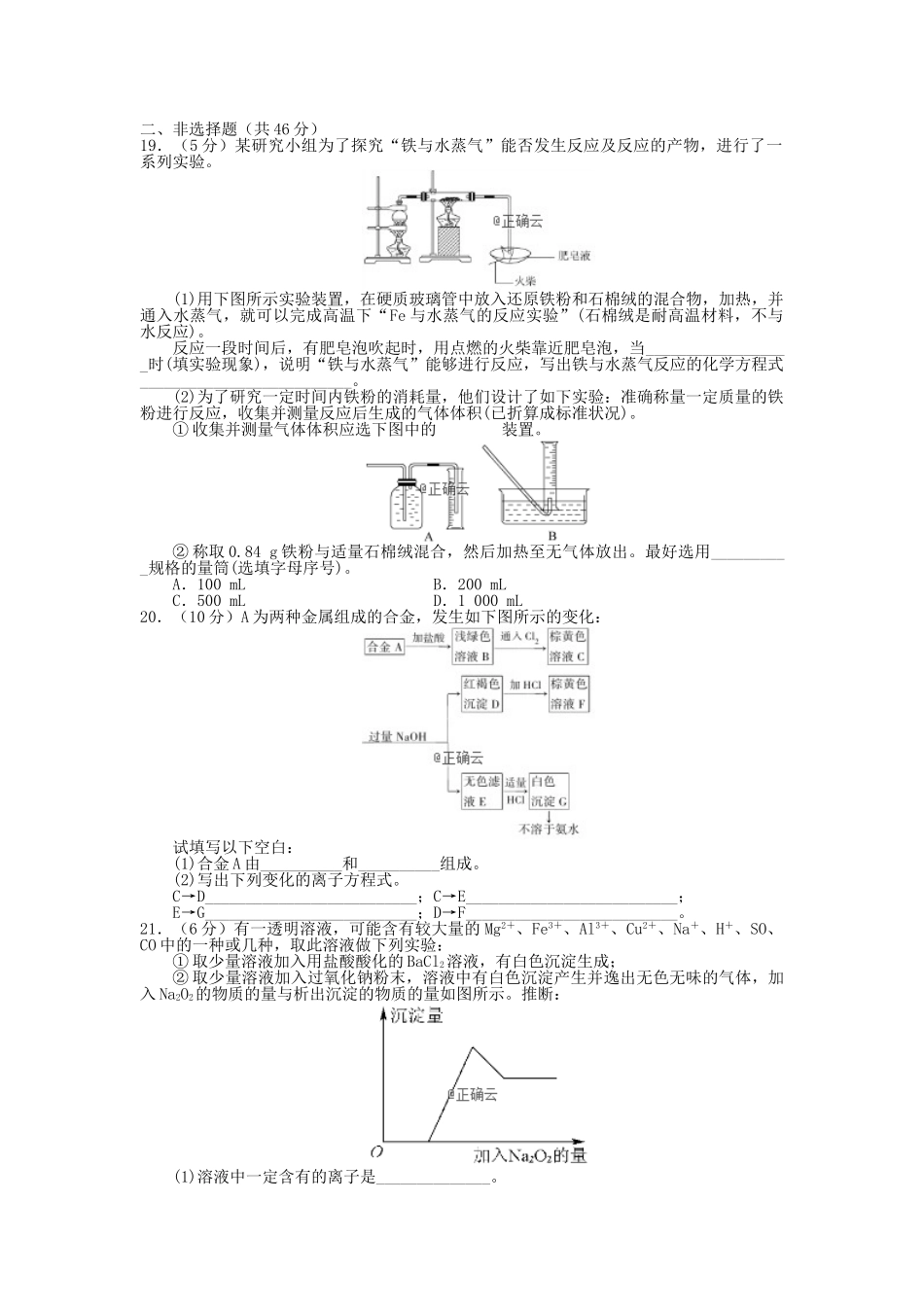
吉林省延边市长白山第一高级中学2023学年高一化学上学期学科竞赛试题时间:90分钟分值:100分可能用到的相对原子质量:Na-23、Al-27、Fe-56、H-1、O-16、Cl-35.5一、选择题(每小题3分,共54分。每小题只有一个选项符合题意)1.每次进行焰色反应时,所用铂丝都要用试剂洗涤,这种试剂是()A、稀盐酸B、碳酸钠溶液C、硫酸D、氢氧化钾溶液2.向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图象中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量)()3.下列说法中正确的是()A.标准状况下,22.4L水中所含的分子数约为6.02×1023个B.1molCl2中含有的原子数为NAC.标准状况下,11.2L氧气和氮气的混合物含有的分子数约为0.5NAD.常温常压下,11.2LCO分子数是0.5NA4.向500mL...