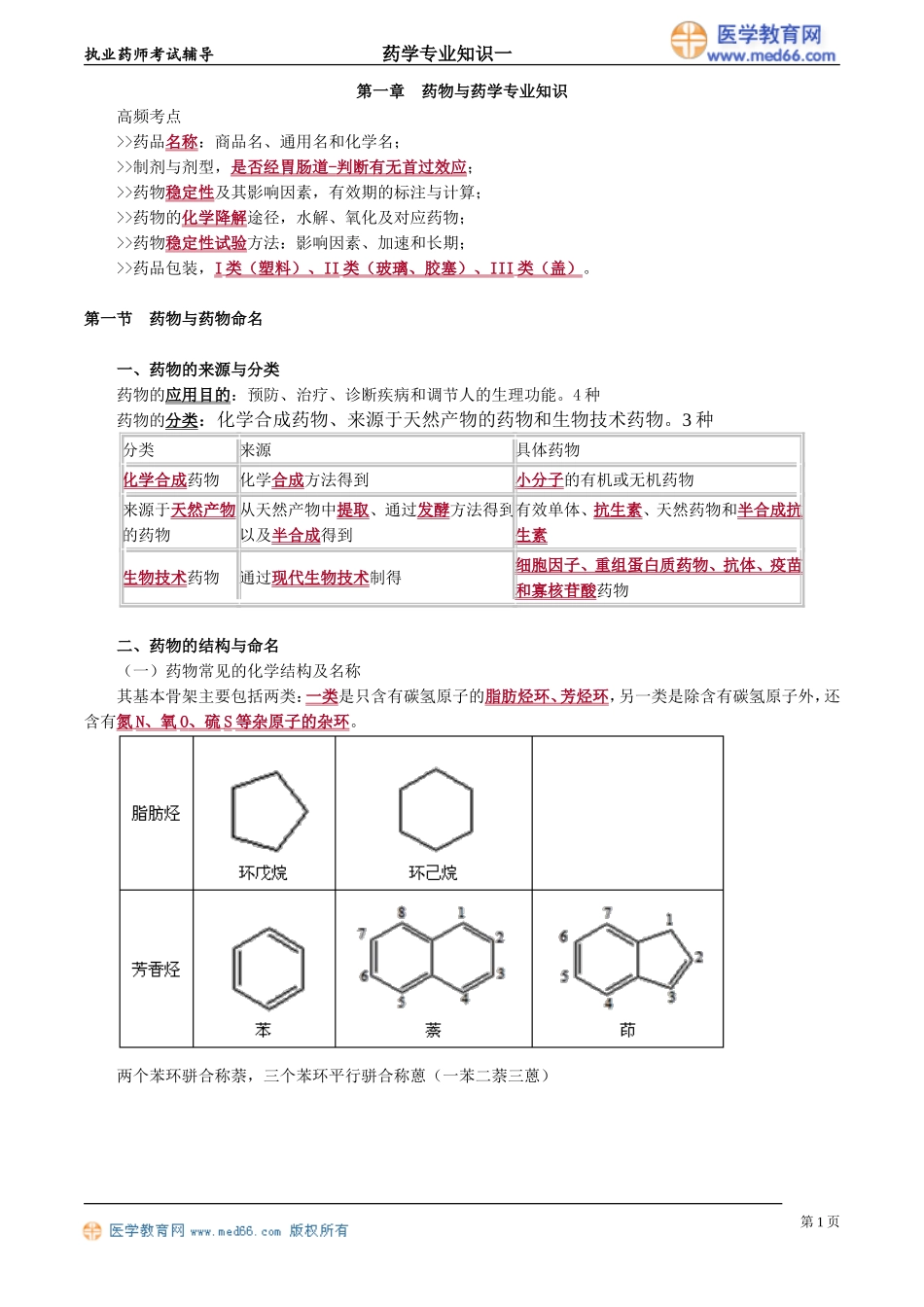
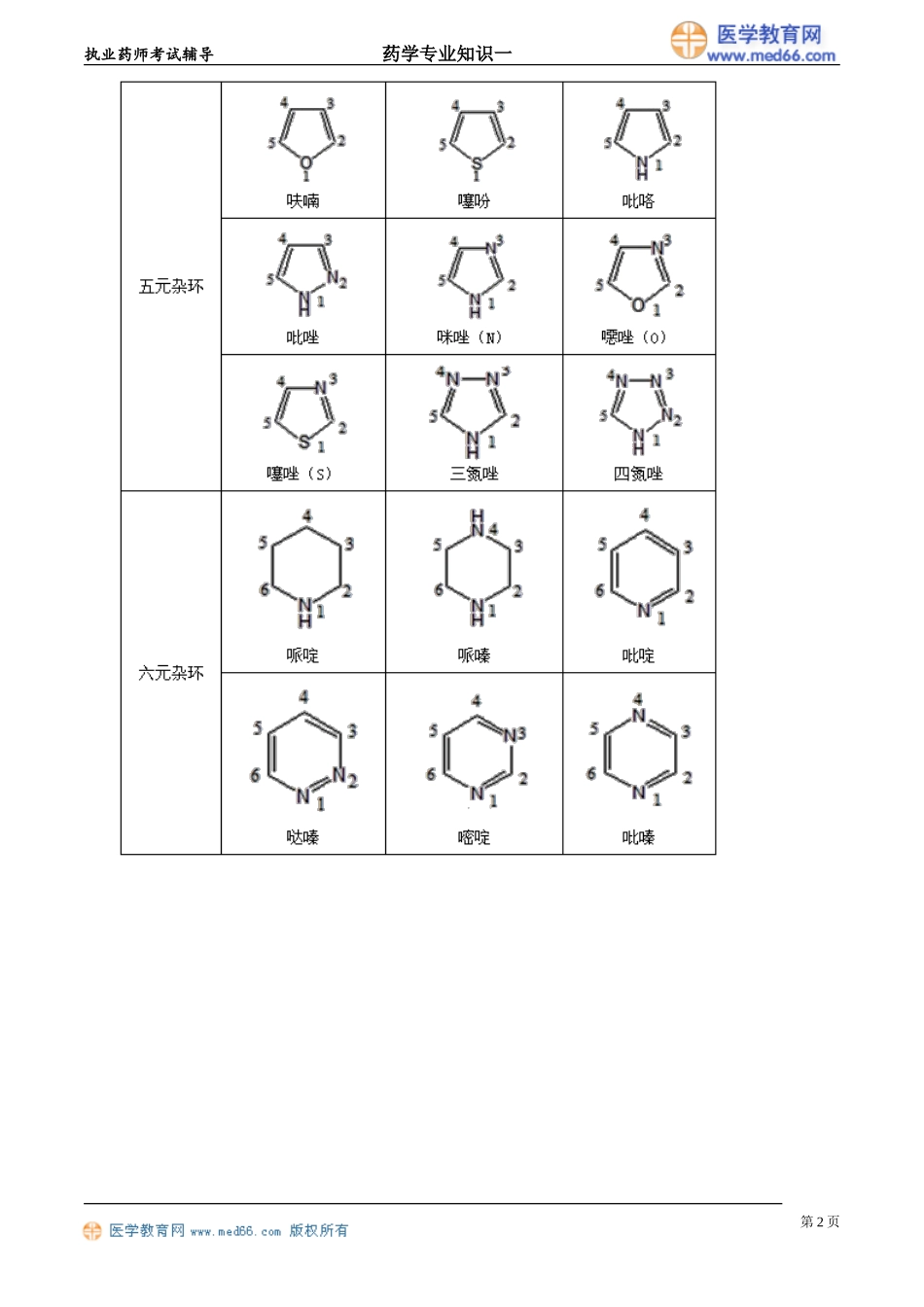
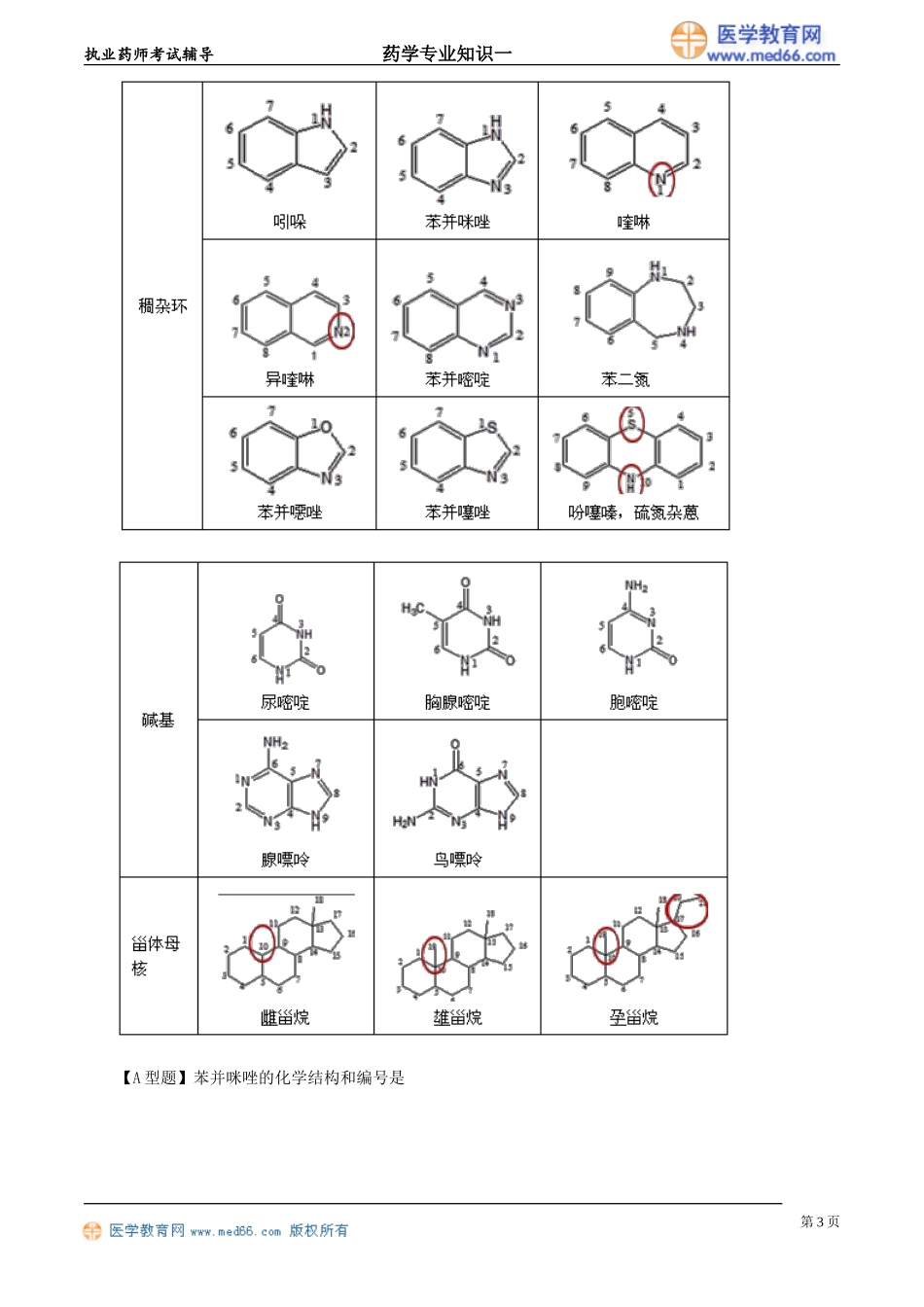
执业药师考试辅导药学专业知识一第一章药物与药学专业知识高频考点>>药品名称:商品名、通用名和化学名;>>制剂与剂型,是否经胃肠道-判断有无首过效应;>>药物稳定性及其影响因素,有效期的标注与计算;>>药物的化学降解途径,水解、氧化及对应药物;>>药物稳定性试验方法:影响因素、加速和长期;>>药品包装,I类(塑料)、II类(玻璃、胶塞)、III类(盖)。第一节药物与药物命名一、药物的来源与分类药物的应用目的:预防、治疗、诊断疾病和调节人的生理功能。4种药物的分类:化学合成药物、来源于天然产物的药物和生物技术药物。3种分类来源具体药物化学合成药物化学合成方法得到小分子的有机或无机药物来源于天然产物的药物从天然产物中提取、通过发酵方法得到以及半合成得到有效单体、抗生素、天然药物和半合成抗生素生物技术药物通过现代生物技术制得细胞因子、重组蛋白质药物、抗体、疫苗和寡核苷酸药物二、药物的结构与命名(一)药物常见的化学结构及名称其基本骨架主要包括两类:一类是只含有碳氢原子的脂肪烃环、芳烃环,另一类是除含有碳氢原子外,还含有氮N、氧O、硫S等杂原子的杂环。两个苯环骈合称萘,三个苯环平行骈合称蒽(一苯二萘三蒽)第1页执业药师考试辅导药学专业知识一第2页执业药师考试辅导药学专业知识一【A型题】苯并咪唑的化学结构和编号是第3页执业药师考试辅导药学专业知识一『正确答案』D『答案解析』A项是茚;B项是苯并噁唑;C项是苯并嘧啶;E项是苯并噻唑。【A型题】含有喹啉酮环母核结构的药物是『正确答案』B『答案解析』环丙沙星属于氟喹诺酮类药物。(二)常见的药物命名药物的名称包括药物的通用名、化学名和商品名。1.药物的商品名(1)通常是针对药物的最终产品,剂型和剂量确定,如代文、泰诺、斯达舒等。(2)制药企业拥有专利权,不得冒用、顶替。第4页执业药师考试辅导药学专业知识一(3)选用的商品名不能暗示疗效和用途,最好简单顺口。2.药品的通用名(1)也称国际非专利药品名称(INN),世界卫生组织(WHO)推荐使用。(2)INN通常指有活性的药物物质,而非最终药品。(3)一个药物只有一个通用名,新药申请过程中向世界卫生组织提出,不受专利保护,不能与已有名称相同,不能与商品名近似。(4)药典使用的名称,与英文名对应,多采用音译。3.药物的化学名(1)标明药品化学结构的名称。(2)依据:国际纯化学和应用化学会(IUPAC)、中国化学会、美国化学文献(CA)的原则。(3)命名原则:...