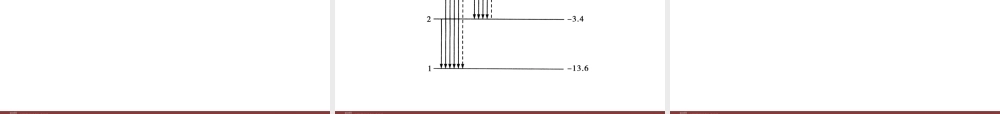
第十八章原子结构第四节玻尔的原子模型学习目标定位※了解玻尔原子模型及能级的概念※理解原子发射和吸收光子的频率与能级差的关系※知道玻尔对氢光谱的解释以及玻尔理论的局限性课堂情景切入霓虹灯发出的光,线条结构丰富,色彩鲜艳、绚丽多姿,形状、色彩变幻莫测,令人赏心悦目。一幅幅流动的画面,似天上彩虹,像人间银河,更酷似一个梦幻世界,使人难以忘怀。霓虹灯是一种增添节日欢快气氛和进行广告宣传的最佳光源,霓虹灯的亮、美、动特点,在各类新型光源中独领风骚。同学们,你们知道霓虹灯的发光原理吗?知识自主梳理知识点1玻尔原子理论的基本假设1.轨道量子化与定态(1)轨道量子化:原子中的电子在的作用下,绕原子核做圆周运动,电子运动轨道的不是任意的,而是化的。电子在这些轨道上绕核的转动是的,不产生辐射。库仑力半径量子稳定电磁(2)定态:当电子在不同的轨道上运动时,原子处于不同的。原子在不同的中具有不同的能量,因此,原子的能量是化的。这些化的能量值叫做,原子中这些具有确定能量的稳定状态,称为。①基态:能量最的状态叫做基态。②激发态:基态的能量状态叫做激发态。状态状态量子量子能级定态低之外2.频率条件电子从能量的定态轨道跃迁到能量的定态轨道时,会向外辐射能量,辐射的能量是的,光子的能量由两个能级的决定。=Em-En这个式子称为频率条件,也叫条件,式中的h为普朗克常量,ν为光子的。较高较低一份一份能量差Hν辐射频率知识点2玻尔理论对氢光谱的解释原子从能态向能态跃迁时,放出的光子的能量等于前后两个能级之,由于原子的能级是的,所以放出的光子的能量也是的,因此原子的发射光谱只有一些的亮线。高低差分立分立分立知识点3玻尔理论的局限性1.玻尔理论的成功之处玻尔理论第一次将引入原子领域。提出了和的概念,成功解释了光谱的实验规律。2.玻尔理论的局限性过多地保留了理论,即保留的观念,把电子的运动看做经典力学描述下的运动。量子观念定态跃迁氢原子经典经典粒子轨道3.电子云原子中的电子确定的坐标值,我们只能描述电子在某个位置出现的多少,把电子这种分布用疏密不同的点表示时,这种图象就像云雾一样分布在原子核周围,故称电子云。没有概率概率重点难点突破一、玻尔原子模型1.轨道量子化(1)轨道半径只能是一些不连续的、某些分立的数值。(2)轨道半径公式:rn=n2r1,式中n称为量子数,对应不同的轨道,只能取正整数。氢原子的最小轨道半径r1=0.53×10-10m。2.能量量子...