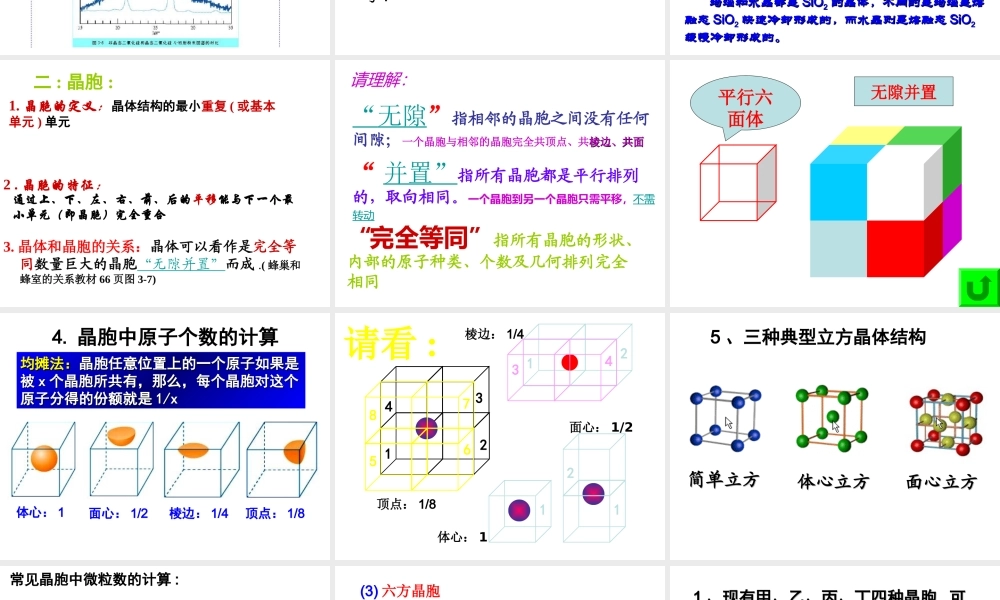
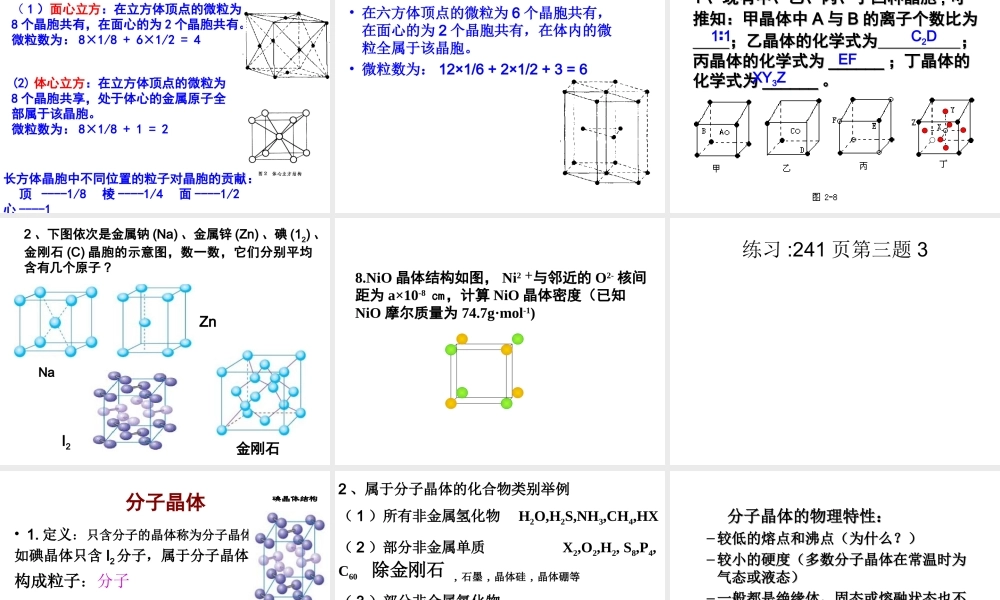
11、、结构特征::晶体晶体————结构微粒在微观空间里结构微粒在微观空间里呈周期性有序排列呈周期性有序排列非晶体非晶体————结构微粒无序排列结构微粒无序排列一、晶体和非晶体一、晶体和非晶体2晶体与非晶体的性质特征•说明:–晶体自范性的本质:是晶体中粒子在微观空间里呈现周期性的有序排列的宏观表象。–晶体自范性的条件之一:生长速率适当。自范性微观结构晶体有(能自发呈封闭的规则的多面体外形)原子在三维空间里呈周期性有序排列非晶体没有(不能自发呈现多面体外形)原子排列相对无序晶体的特性<2>.有固定的熔沸点(非晶体有固定的熔沸点)(常用于区分晶体和非晶体)<3>.各向异性(强度、导热性、光学性质等)(不同方向上质点排列一般是不一样的,因此,晶体的性质也随方向的不同而有所差异。)<4>.当一波长的x-射线通过晶体时,会在记录仪上看到分立的斑点或者普线.区分晶体和非晶体最可靠的科学方法是:对固体进行X—射线衍射实验3、晶体形成的途径•熔融态物质凝固。(注)•气态物质冷却不经液态直接凝固(凝华)。•溶质从溶液中析出。练习:241页深度思考1天然水晶球里的玛瑙和水晶玛瑙和水晶都是玛瑙和水晶都是SiOSiO22的晶体,不同的是玛瑙是熔的晶体,不同的是玛瑙是熔融态融态SiOSiO22快速冷却形成的,而水晶则是熔融态快速冷却形成的,而水晶则是熔融态SiOSiO22缓慢冷却形成的。缓慢冷却形成的。玛瑙玛瑙水晶水晶1.晶胞的定义:晶体结构的最小重复(或基本单元)单元2.晶胞的特征:通过上、下、左、右、前、后的平移能与下一个最小单元(即晶胞)完全重合二:晶胞:3.晶体和晶胞的关系:晶体可以看作是完全等同数量巨大的晶胞“无隙并置”而成.(蜂巢和蜂室的关系教材66页图3-7)“并置”指所有晶胞都是平行排列的,取向相同。一个晶胞到另一个晶胞只需平移,不需转动“无隙”指相邻的晶胞之间没有任何间隙;一个晶胞与相邻的晶胞完全共顶点、共棱边、共面棱边、共面请理解:“完全等同”指所有晶胞的形状、内部的原子种类、个数及几何排列完全相同平行六面体无隙并置体心:1面心:1/2顶点:1/8棱边:1/44.晶胞中原子个数的计算均摊法:均摊法:晶胞任意位置上的一个原子如果是晶胞任意位置上的一个原子如果是被被xx个晶胞所共有,那么,每个晶胞对这个个晶胞所共有,那么,每个晶胞对这个原子分得的份额就是原子分得的份额就是1/x1/x12437685122134请看:1体心:1面心:1/2顶点:1/8棱边:1/45、三种典型立方晶体结...