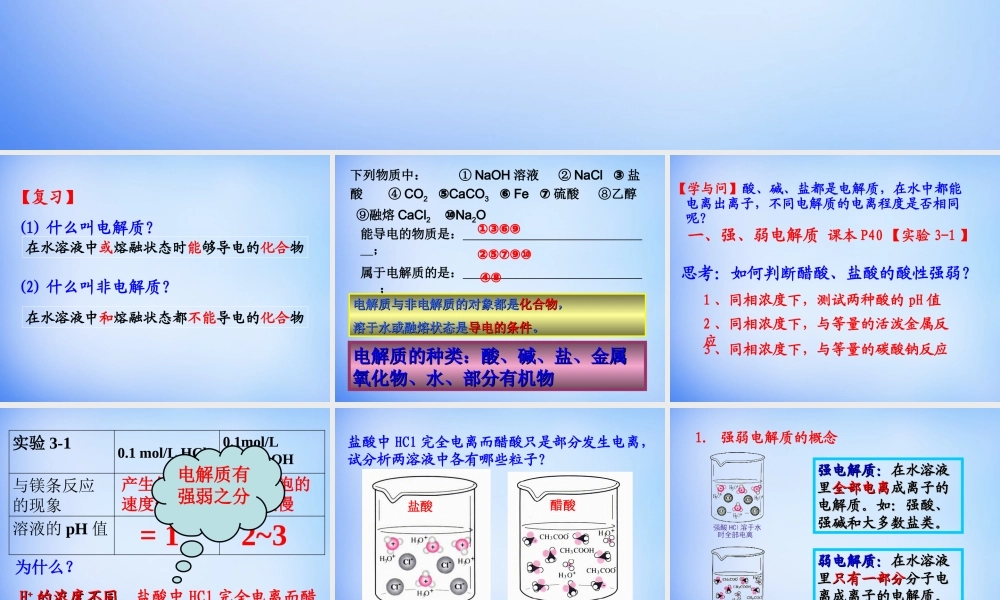
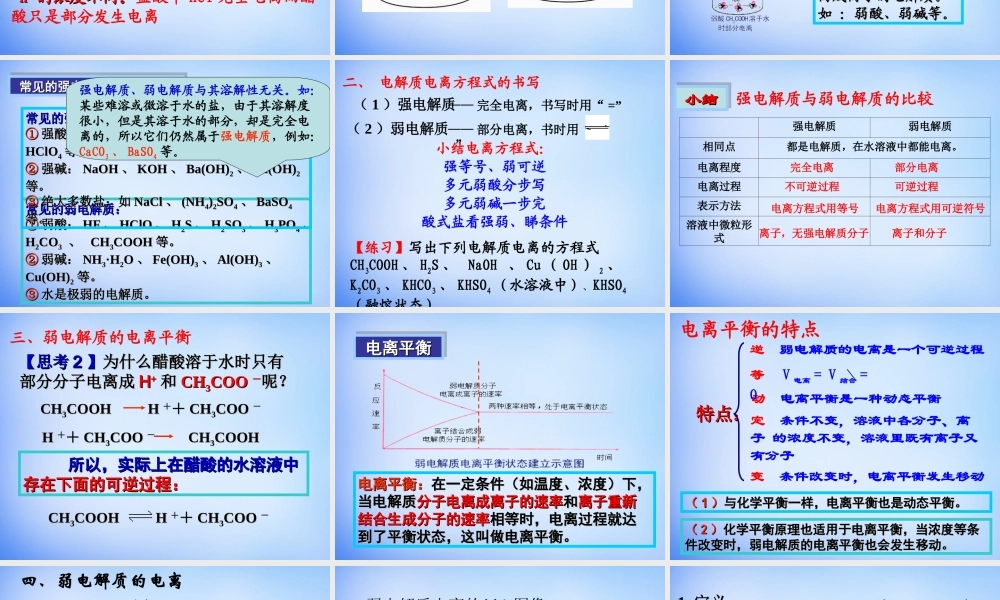
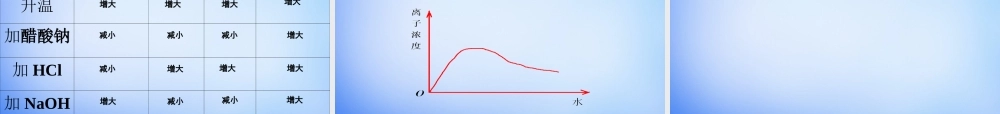
第三章水溶液中的离子平衡第一节弱电解质的电离(1)什么叫电解质?(2)什么叫非电解质?【复习】在水溶液中或熔融状态时能够导电的化合物在水溶液中和熔融状态都不能导电的化合物下列物质中:①NaOH溶液②NaCl③盐酸④CO2CaCO⑤3Fe⑥⑦硫酸⑧乙醇⑨融熔CaCl2Na⑩2O能导电的物质是:;属于电解质的是:;属于非电解质的是:;电解质与非电解质的对象都是电解质与非电解质的对象都是化合物化合物,,溶于水或融熔状态是溶于水或融熔状态是导电的条件导电的条件。。①③⑥⑨②⑤⑦⑨⑩④⑧电解质的种类:酸、碱、盐、金属电解质的种类:酸、碱、盐、金属氧化物、水、部分有机物氧化物、水、部分有机物一、强、弱电解质【学与问】酸、碱、盐都是电解质,在水中都能电离出离子,不同电解质的电离程度是否相同呢?课本P40【实验3-1】思考:如何判断醋酸、盐酸的酸性强弱?1、同相浓度下,测试两种酸的pH值2、同相浓度下,与等量的活泼金属反应3、同相浓度下,与等量的碳酸钠反应实验3-10.1mol/LHCl0.1mol/LCH3COOH与镁条反应的现象溶液的pH值产生气泡的速度较快产生气泡的速度较慢=12~3为什么?HH++的浓度不同。的浓度不同。盐酸中HCl完全电离而醋酸只是部分发生电离电解质有强弱之分盐酸中HCl完全电离而醋酸只是部分发生电离,试分析两溶液中各有哪些粒子?盐酸醋酸强电解质:强电解质:在水溶液在水溶液里里全部电离全部电离成离子的成离子的电解质。如:强酸、电解质。如:强酸、强碱和大多数盐类。强碱和大多数盐类。弱电解质:弱电解质:在水溶液在水溶液里里只有一部分只有一部分分子电分子电离成离子的电解质。离成离子的电解质。如:弱酸、弱碱等。如:弱酸、弱碱等。1.强弱电解质的概念常见的弱电解质:常见的弱电解质:①①弱酸:弱酸:HFHF、、HClOHClO、、HH22SS、、HH22SOSO33、、HH33POPO44、、HH22COCO33、、CHCH33COOHCOOH等。等。②②弱碱:弱碱:NHNH33·H·H22OO、、Fe(OH)Fe(OH)33、、Al(OH)Al(OH)33、、Cu(OH)Cu(OH)22等。等。③③水是极弱的电解质。水是极弱的电解质。常见的强电解质:常见的强电解质:①①强酸:强酸:HClHCl、、HBrHBr、、HIHI、、HH22SOSO44、、HNOHNO33、、HClOHClO44等。等。②②强碱:强碱:NaOHNaOH、、KOHKOH、、Ba(OH)Ba(OH)22、、Ca(OH)Ca(OH)22等。等。③③绝大多数盐:如绝大多数盐:如NaClNaCl、、(NH(NH44))22SOSO44、、BaSOBaSO44等。等。常见的强电解质和弱电解质常见的强电解质和弱电解质常见的强...