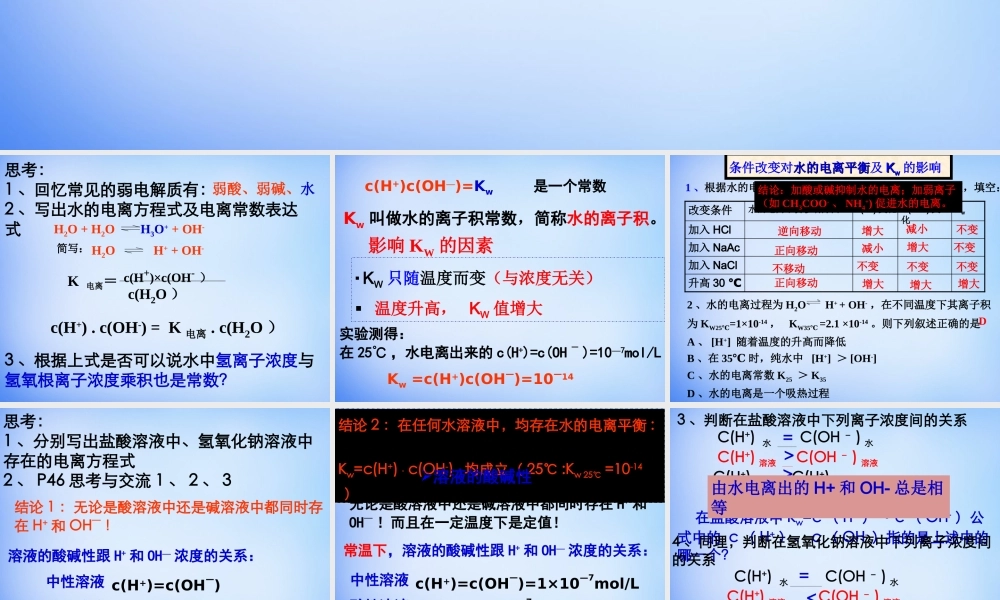
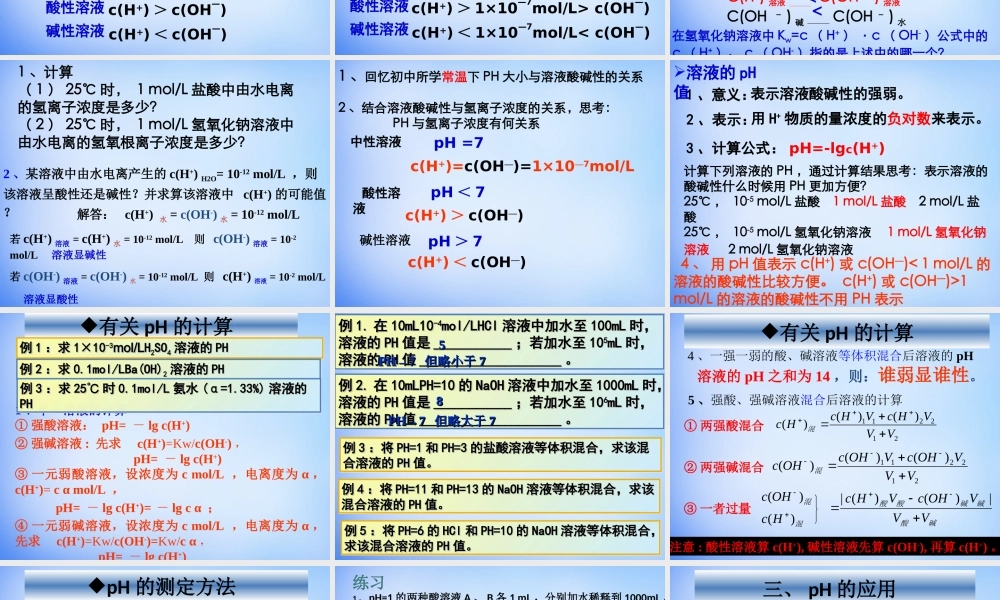
第三章水溶液中的离子平衡第二节水的电离和溶液的酸碱性思考:1、回忆常见的弱电解质有:2、写出水的电离方程式及电离常数表达式弱酸、弱碱、水H2O+H2OH3O++OH-H2OH++OH-简写:K电离=c(H+)×c(OH-)c(H2O)3、根据上式是否可以说水中氢离子浓度与氢氧根离子浓度乘积也是常数?c(H+).c(OH-)=K电离.c(H2O)实验测得:在25℃,水电离出来的c(H+)=c(OH-)=10—7mol/LKw=c(H+)c(OH—)=10—14是一个常数c(H+)c(OH—)=KwKw叫做水的离子积常数,简称水的离子积。影响KW的因素KW只随温度而变(与浓度无关)温度升高,KW值增大2、水的电离过程为H2OH++OH-,在不同温度下其离子积为KW25℃=1×10-14,KW35℃=2.1×10-14。则下列叙述正确的是A、[H+]随着温度的升高而降低B、在35℃时,纯水中[H+]>[OH-]C、水的电离常数K25>K35D、水的电离是一个吸热过程D1、根据水的电离平衡H2OH++OH-和下列条件的改变,填空:升高30℃加入NaCl加入NaAc加入HClKwC(OH-)变化C(H+)变化水的电离平衡移动方向改变条件条件改变对水的电离平衡水的电离平衡及KKww的影响减小逆向移动正向移动正向移动不移动增大增大增大增大增大减小不变不变不变不变不变结论:加酸或碱抑制水的电离;加弱离子(如CH3COO-、NH4+)促进水的电离。思考:1、分别写出盐酸溶液中、氢氧化钠溶液中存在的电离方程式2、P46思考与交流1、2、3结论1:无论是酸溶液中还是碱溶液中都同时存在H+和OH—!溶液的酸碱性跟H+和OH—浓度的关系:中性溶液酸性溶液碱性溶液c(H+)=c(OH—)c(H+)>c(OH—)c(H+)<c(OH—)结论2:在任何水溶液中,均存在水的电离平衡:Kw=c(H+)·c(OH-)均成立(25℃:Kw25℃=10-14)溶液的酸碱性无论是酸溶液中还是碱溶液中都同时存在H+和OH—!而且在一定温度下是定值!常温下,溶液的酸碱性跟H+和OH—浓度的关系:中性溶液酸性溶液碱性溶液c(H+)=c(OH—)=1×10—7mol/Lc(H+)>1×10—7mol/L>c(OH—)c(H+)<1×10—7mol/L><<由水电离出的H+和OH-总是相等1、计算(1)25℃时,1mol/L盐酸中由水电离...