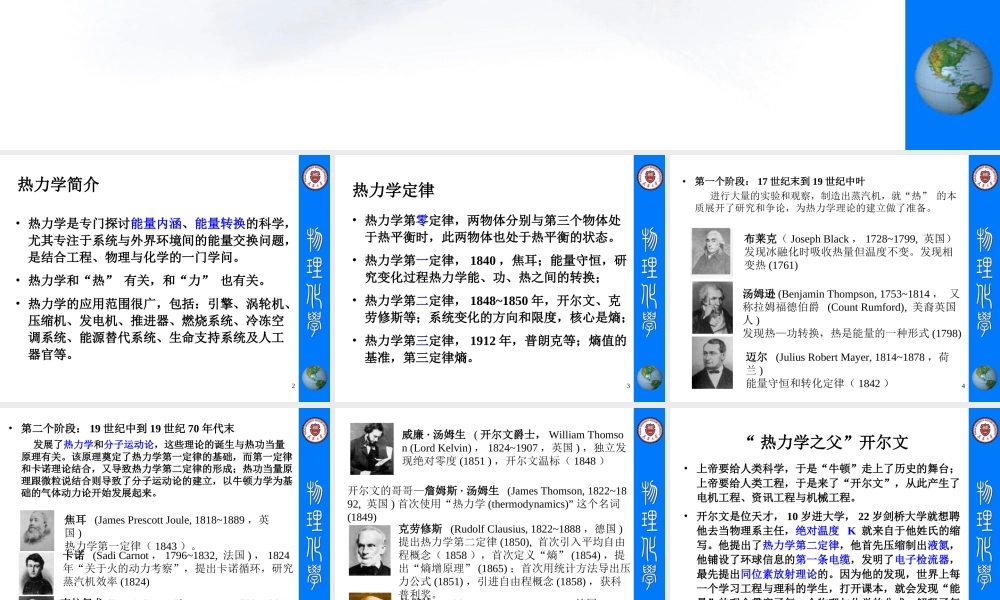
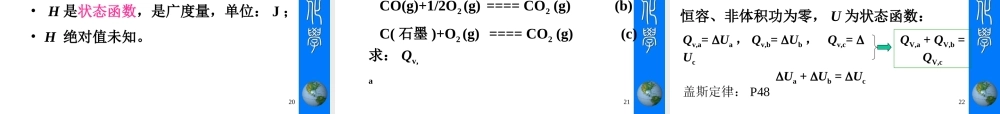热力学第一定律第二章2•热力学是专门探讨能量内涵、能量转换的科学,尤其专注于系统与外界环境间的能量交换问题,是结合工程、物理与化学的一门学问。•热力学和“热”有关,和“力”也有关。•热力学的应用范围很广,包括:引擎、涡轮机、压缩机、发电机、推进器、燃烧系统、冷冻空调系统、能源替代系统、生命支持系统及人工器官等。热力学简介3热力学定律•热力学第零定律,两物体分别与第三个物体处于热平衡时,此两物体也处于热平衡的状态。•热力学第一定律,1840,焦耳;能量守恒,研究变化过程热力学能、功、热之间的转换;•热力学第二定律,1848~1850年,开尔文、克劳修斯等;系统变化的方向和限度,核心是熵;•热力学第三定律,1912年,普朗克等;熵值的基准,第三定律熵。4•第一个阶段:17世纪末到19世纪中叶进行大量的实验和观察,制造出蒸汽机,就“热”的本质展开了研究和争论,为热力学理论的建立做了准备。布莱克(JosephBlack,1728~1799,英国)发现冰融化时吸收热量但温度不变。发现相变热(1761)汤姆逊(BenjaminThompson,1753~1814,又称拉姆福德伯爵(CountRumford),美裔英国人)发现热—功转换,热是能量的一种形式(1798)迈尔(JuliusRobertMayer,1814~1878,荷兰)能量守恒和转化定律(1842)5•第二个阶段:19世纪中到19世纪70年代末发展了热力学和分子运动论,这些理论的诞生与热功当量原理有关。该原理奠定了热力学第一定律的基础,而第一定律和卡诺理论结合,又导致热力学第二定律的形成;热功当量原理跟微粒说结合则导致了分子运动论的建立,以牛顿力学为基础的气体动力论开始发展起来。焦耳(JamesPrescottJoule,1818~1889,英国)热力学第一定律(1843)。克拉佩龙(Benoit-PierreClapeyron,1799~1864,法国)根据对蒸汽机的研究,首次提出热力学第二定律(1834)。卡诺(SadiCarnot,1796~1832,法国),1824年“关于火的动力考察”,提出卡诺循环,研究蒸汽机效率(1824)6威廉·汤姆生(开尔文爵士,WilliamThomson(LordKelvin),1824~1907,英国),独立发现绝对零度(1851),开尔文温标(1848)开尔文的哥哥—詹姆斯·汤姆生(JamesThomson,1822~1892,英国)首次使用“热力学(thermodynamics)”这个名词(1849)克劳修斯(RudolfClausius,1822~1888,德国)提出热力学第二定律(1850),首次引入平均自由程概念(1858),首次定义“熵”(1854),提出“熵增原理”(1865);首次用统计方法导出压力公式(1851),引进自由程概念(1858),获科普...