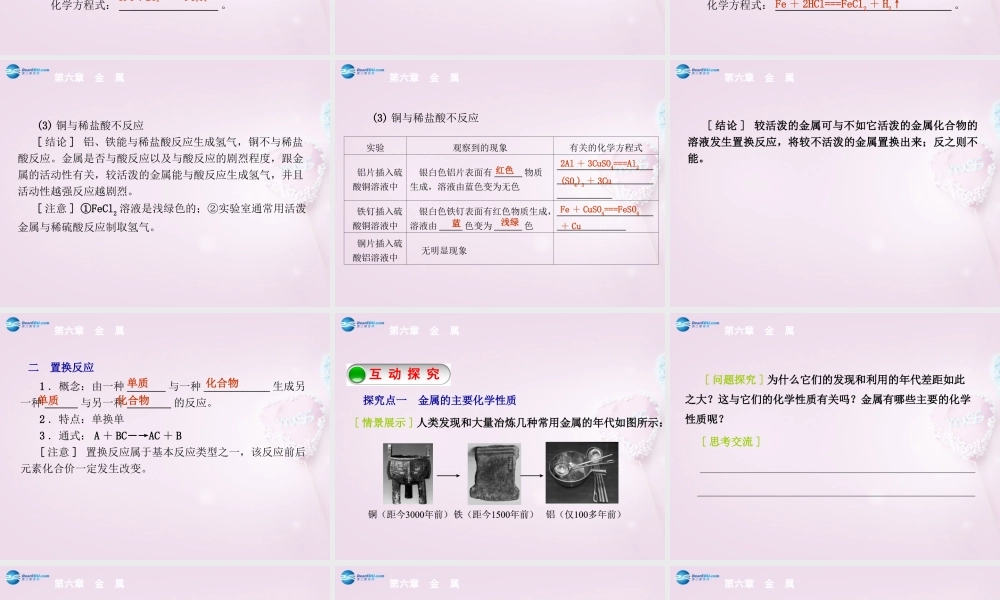
化学新知预习新知预习互动探究互动探究课堂小结课堂小结问题导学问题导学当堂检测当堂检测第六章金属问题导学新知预习1.大多数金属能与氧气反应生成氧化物(1)镁与氧气的反应常温下,镁跟空气中的氧气反应,生成很薄的_______;点燃时,镁带可燃烧。现象:_________________________________________________。化学方程式:_____________________。第六章金属氧化膜一金属的主要化学性质发出耀眼白光,放出热量,生成白色粉末状的固体2Mg+O2=====点燃2MgO(2)铁与氧气的反应常温下,纯铁不易氧化;在纯氧中点燃铁丝,铁丝可燃烧。[注意]在实验前,铁丝表面应______________,目的是除去表面的铁锈;集气瓶底部应____________或铺一层细沙,目的是_____________________________。现象:_________________________________________。化学方程式:__________________。第六章金属用砂纸打磨留少量水防止溅落的熔融物炸裂集气瓶底剧烈燃烧、火星四射,放出热量,生成黑色固体3Fe+2O2=====点燃Fe3O4(3)铜在加热情况下与氧气反应现象:______________________。化学方程式:__________________。(4)“”真金不怕火炼说明金___________________,即使在高温下也不与氧气反应。[结论]许多金属都能与氧气反应,生成氧化物。第六章金属红色固体表面变成黑色2Cu+O2=====△2CuO化学性质稳定2.金属与稀盐酸(或稀硫酸)的反应(1)铝与稀盐酸反应现象:______________________________。化学方程式:_______________________________。[提示]铝片在实验前先用砂纸打磨,除去表面致密的氧化膜。(2)铁与稀盐酸反应现象:________________________________。化学方程式:________________________________。第六章金属反应剧烈,产生大量气泡2Al+6HCl===2AlCl3+3H2↑产生气泡,溶液由无色变成浅绿色Fe+2HCl===FeCl2+H2↑(3)铜与稀盐酸不反应[结论]铝、铁能与稀盐酸反应生成氢气,铜不与稀盐酸反应。金属是否与酸反应以及与酸反应的剧烈程度,跟金属的活动性有关,较活泼的金属能与酸反应生成氢气,并且活动性越强反应越剧烈。[注意]①FeCl2溶液是浅绿色的;②实验室通常用活泼金属与稀硫酸反应制取氢气。第六章金属(3)铜与稀盐酸不反应第六章金属实验观察到的现象有关的化学方程式铝片插入硫酸铜溶液中银白色铝片表面有______物质生成,溶液由蓝色变为无色______________________________________________________铁钉插入硫酸铜溶液中银白色铁钉表面有红色物质...