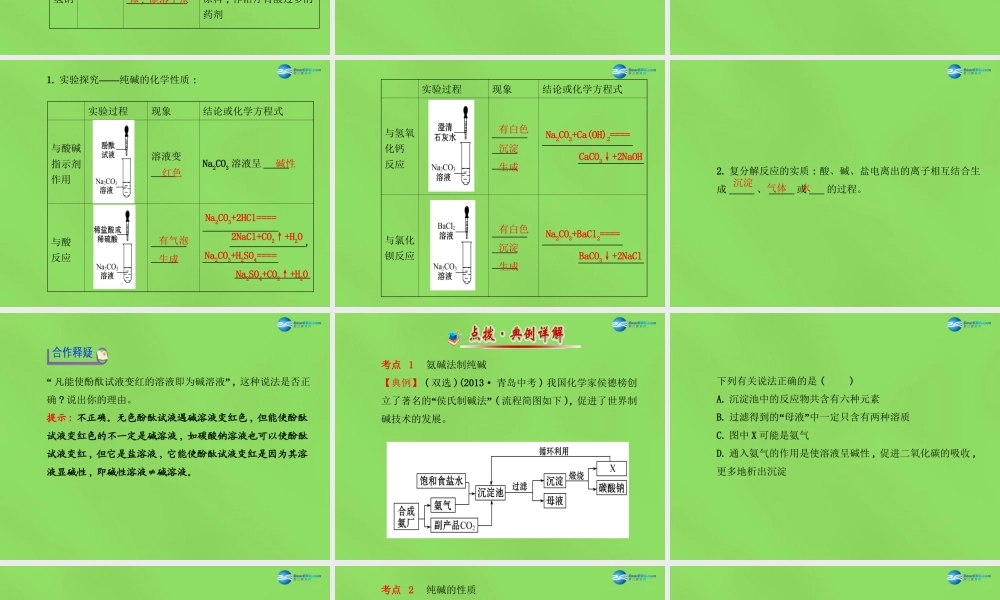
第三节海水“制碱”学习主题一氨碱法制纯碱【问题导引】氨碱法制纯碱需要哪些原料?制备过程的反应原理是什么?1.原料:_____、_______。2.媒介:_____。食盐石灰石氨气3.生产流程:通CO24.反应原理:_______________________________;____________________________。5.侯氏制碱法:我国化学家_______在氨碱法的基础上,创立了侯氏制碱法,克服了氨碱法的缺点,促进了制碱技术发展。△====NaCl+NH3+CO2+H2O====NaHCO3+NH4Cl2NaHCO3Na2CO3+H2O+CO2↑侯德榜6.碳酸钠、碳酸氢钠的物理性质和用途:俗称物理性质用途碳酸钠纯碱、________________________化工原料,广泛应用于冶金、造纸、纺织、印染、洗涤剂生产等领域碳酸氢钠________________________________灭火器里二氧化碳的发生剂;制造发酵粉、饮料的原料;作治疗胃酸过多的药剂苏打白色粉末,易溶于水小苏打白色粉末状晶体,能溶于水实验发现氨气的水溶液更容易吸收二氧化碳,从酸碱性的角度考虑,你认为可能的原因是什么?提示:氨水显碱性,可中和掉二氧化碳溶于水形成的碳酸,从而更易吸收二氧化碳。学习主题二纯碱的性质【问题导引】碳酸钠能与哪些物质发生反应?反应的现象如何?1.——实验探究纯碱的化学性质:实验过程现象结论或化学方程式与酸碱指示剂作用溶液变_____Na2CO3溶液呈_____与酸反应__________________________________________,______________________________红色碱性有气泡生成Na2CO3+2HCl====2NaCl+CO2↑+H2ONa2CO3+H2SO4====Na2SO4+CO2↑+H2O实验过程现象结论或化学方程式与氢氧化钙反应________________________________________________与氯化钡反应______________________________________________有白色沉淀生成有白色沉淀生成Na2CO3+Ca(OH)2====CaCO3↓+2NaOHNa2CO3+BaCl2====BaCO3↓+2NaCl2.复分解反应的实质:酸、碱、盐电离出的离子相互结合生成_____、_____或___的过程。沉淀气体水“”凡能使酚酞试液变红的溶液即为碱溶液,这种说法是否正确?说出你的理由。提示:不正确。无色酚酞试液遇碱溶液变红色,但能使酚酞试液变红色的不一定是碱溶液,如碳酸钠溶液也可以使酚酞试液变红,但它是盐溶液,它能使酚酞试液变红是因为其溶液显碱性,即碱性溶液≠碱溶液。考点1氨碱法制纯碱【典例】(双选)(2013·青岛中考)我国化学家侯德榜创“”立了著名的侯氏制碱法(流程简图如下),促进了世界制碱技术的发展。下列有关说法正确的是()A.沉淀池中的反应物共含有六种元素B.“”过滤得到的母液中一定只含有两...