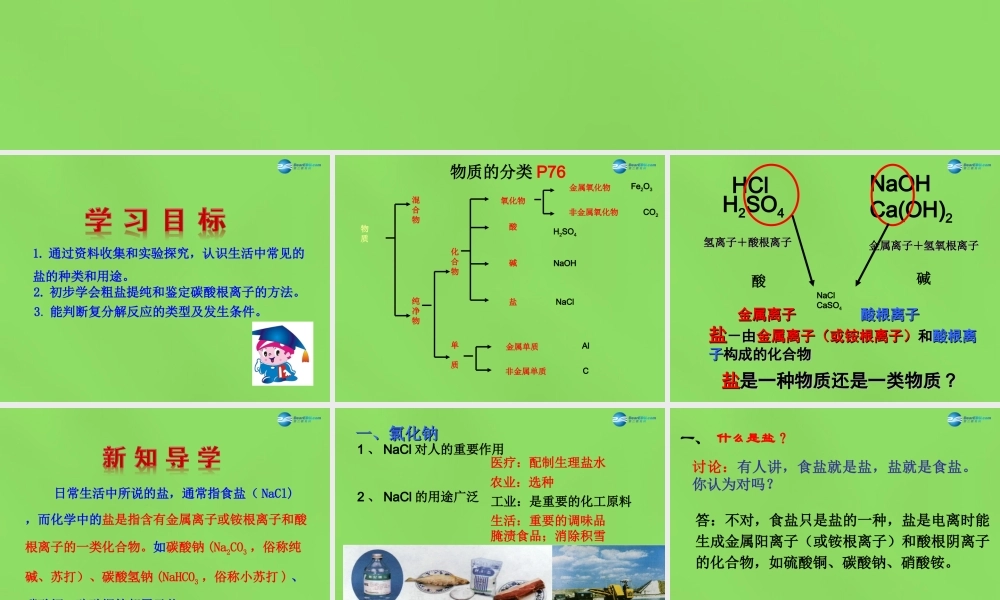
第十一单元盐化肥课题1生活中常见的盐1.通过资料收集和实验探究,认识生活中常见的盐的种类和用途。2.初步学会粗盐提纯和鉴定碳酸根离子的方法。3.能判断复分解反应的类型及发生条件。物质的分类P76物质混合物纯净物化合物单质金属单质非金属单质碱酸氧化物盐CAlNaClNaOHH2SO4Fe2O3金属氧化物非金属氧化物CO2HClH2SO4NaOHCa(OH)2氢离子+酸根离子氢离子+酸根离子金属离子+氢氧根离子金属离子+氢氧根离子酸碱盐盐-由-由金属离子(或铵根离子)金属离子(或铵根离子)和和酸根离酸根离子子构成的化合物构成的化合物NaClCaSO4金属离子金属离子酸根离子酸根离子盐盐是一种物质还是一类物质是一种物质还是一类物质??日常生活中所说的盐,通常指食盐(NaCl),而化学中的盐是指含有金属离子或铵根离子和酸根离子的一类化合物。如碳酸钠(Na2CO3,俗称纯碱、苏打)、碳酸氢钠(NaHCO3,俗称小苏打)、碳酸钙、硫酸铜等都属于盐。一、氯化钠一、氯化钠1、NaCl对人的重要作用2、NaCl的用途广泛3、NaCl在自然界的分布医疗:配制生理盐水农业:选种工业:是重要的化工原料生活:重要的调味品腌渍食品;消除积雪一、什么是盐?讨论:有人讲,食盐就是盐,盐就是食盐。你认为对吗?答:不对,食盐只是盐的一种,盐是电离时能生成金属阳离子(或铵根离子)和酸根阴离子的化合物,如硫酸铜、碳酸钠、硝酸铵。亚硝酸钠亚硝酸钠是一种工业用盐,它有是一种工业用盐,它有毒、有咸味,外形与食盐相似。人若毒、有咸味,外形与食盐相似。人若误食会误食会引起中毒引起中毒,危害人体健康,甚,危害人体健康,甚至死亡。亚硝酸钠的水溶液呈碱性,至死亡。亚硝酸钠的水溶液呈碱性,食盐水溶液呈中性。如果让你来鉴别食盐水溶液呈中性。如果让你来鉴别亚硝酸钠和食盐,你选用什么试剂,亚硝酸钠和食盐,你选用什么试剂,如何操作?如何操作?亚硝酸钠亚硝酸钠是一种工业用盐,它有是一种工业用盐,它有毒、有咸味,外形与食盐相似。人若毒、有咸味,外形与食盐相似。人若误食会误食会引起中毒引起中毒,危害人体健康,甚,危害人体健康,甚至死亡。亚硝酸钠的水溶液呈碱性,至死亡。亚硝酸钠的水溶液呈碱性,食盐水溶液呈中性。如果让你来鉴别食盐水溶液呈中性。如果让你来鉴别亚硝酸钠和食盐,你选用什么试剂,亚硝酸钠和食盐,你选用什么试剂,如何操作?如何操作?海南省东方盐场晒盐一景用海水晒盐或用盐井水、盐湖水煮盐可以使水蒸发,使氯化钠溶液达到饱和,继续蒸...