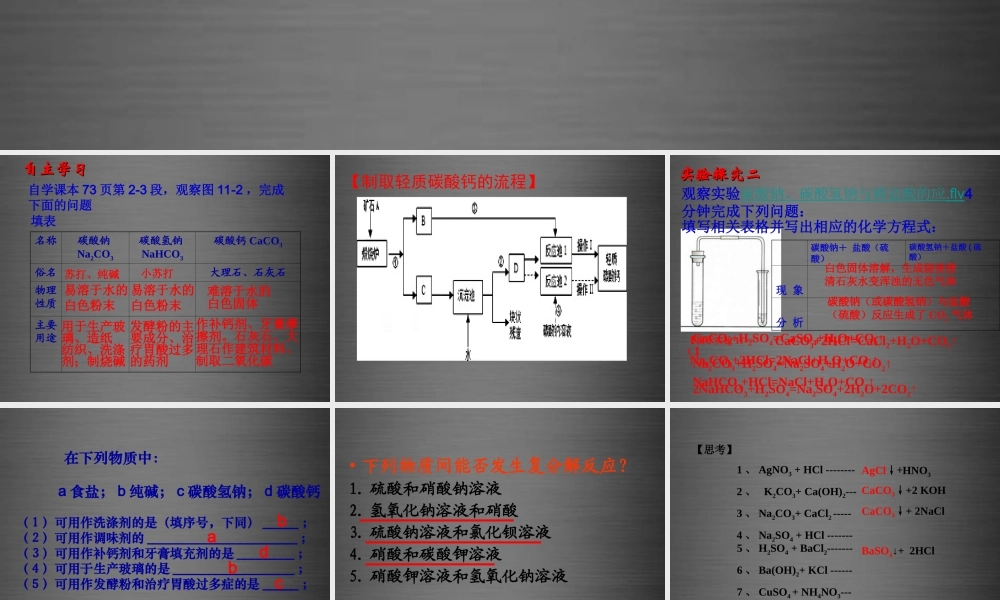
第十一单元盐化肥课题1生活中常见的盐(第二课时)自主学习自主学习名称碳酸钠Na2CO3碳酸氢钠NaHCO3碳酸钙CaCO3俗名大理石、石灰石物理性质主要用途自学课本73页第2-3段,观察图11-2,完成下面的问题填表苏打、纯碱小苏打易溶于水的白色粉末易溶于水的白色粉末用于生产玻璃、造纸纺织、洗涤剂;制烧碱发酵粉的主要成分、治疗胃酸过多的药剂难溶于水的白色固体作补钙剂、牙膏摩擦剂。石灰石、大理石作建筑材料、制取二氧化碳【制取轻质碳酸钙的流程】【演示实验11-1】碳酸钠+盐酸(硫酸)碳酸氢钠+盐酸(硫酸)现象分析白色固体溶解,生成能使澄清石灰水变浑浊的无色气体碳酸钠(或碳酸氢钠)与盐酸(硫酸)反应生成了CO2气体实验探究二实验探究二观察实验碳酸钠、碳酸氢钠与稀盐酸的应.flv4分钟完成下列问题:填写相关表格并写出相应的化学方程式:Na2CO3+2HCl=2NaCl+H2O+CO2↑NaHCO3+HCl=NaCl+H2O+CO2↑CaCO3+2HCl=CaCl2+H2O+CO2↑CaCO3+H2SO4=CaSO4+H2O+CO2↑Na2CO3+H2SO4=Na2SO4+H2O+CO2↑2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑(1)可用作洗涤剂的是(填序号,下同)_____;(2)可用作调味剂的_____________________;(3)可用作补钙剂和牙膏填充剂的是________;(4)可用于生产玻璃的是_________________;(5)可用作发酵粉和治疗胃酸过多症的是_____;bcbda在下列物质中:a食盐;b纯碱;c碳酸氢钠;d碳酸钙•下列物质间能否发生复分解反应?1.硫酸和硝酸钠溶液2.氢氧化钠溶液和硝酸3.硫酸钠溶液和氯化钡溶液4.硝酸和碳酸钾溶液5.硝酸钾溶液和氢氧化钠溶液【思考】1、AgNO3+HCl--------2、K2CO3+Ca(OH)2---3、Na2CO3+CaCl2-----4、Na2SO4+HCl-------5、H2SO4+BaCl2-------6、Ba(OH)2+KCl------7、CuSO4+NH4NO3---8、HNO3+NaOH-----AgCl↓+HNO3CaCO3↓+2KOHCaCO3↓+2NaClBaSO4↓+2HClNaNO3+H2O4、酸+碱→盐+水3、酸+金属氧化物→→盐+水5、酸+(某些)盐→新酸+新盐1、酸与指示剂作用:使紫色石蕊试液变红,不能使无色酚酞试液变色酸2、酸+活泼金属→盐+H2新盐新盐++新碱新碱←←盐盐++碱碱++非金属氧化物非金属氧化物→→盐盐++水水++酸酸→→盐盐++水水使紫色石蕊试液变蓝使无色酚酞试液变红碱溶液与指示剂作用碱+金属→新金属+新盐两种新盐←盐+新碱新碱++新盐新盐←碱碱+++酸→新酸+新盐盐【盐的化学性质】1、盐与金属反应2、盐与酸反应3、盐与碱反应CaCO3+2HCl=CaCl2+H2O+CO2↑Na2CO3+2HCl=2NaCl+H2O+CO2↑NaHCO3+HCl=NaCl+H2O+CO2...