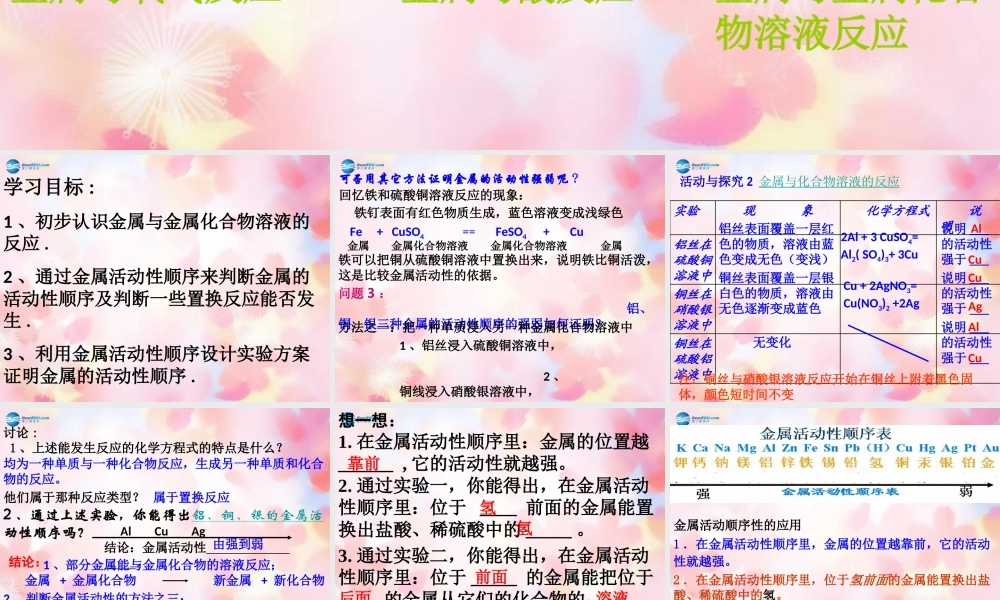
课题2金属的化学性质(二)金属与氧气反应金属与金属化合物溶液反应金属与酸反应学习目标:1、初步认识金属与金属化合物溶液的反应.2、通过金属活动性顺序来判断金属的活动性顺序及判断一些置换反应能否发生.3、利用金属活动性顺序设计实验方案证明金属的活动性顺序.可否用其它方法证明金属的活动性强弱呢?回忆铁和硫酸铜溶液反应的现象:铁钉表面有红色物质生成,蓝色溶液变成浅绿色Fe+CuSO4==FeSO4+Cu铁可以把铜从硫酸铜溶液中置换出来,说明铁比铜活泼,这是比较金属活动性的依据。问题3:铝、铜、银三种金属的活动性顺序的强弱如何证明?金属金属化合物溶液金属化合物溶液金属1、铝丝浸入硫酸铜溶液中,2、铜线浸入硝酸银溶液中,方法之一:把一种单质浸入另一种金属化合物溶液中活动与探究2金属与化合物溶液的反应实验现象化学方程式说明铝丝在硫酸铜溶液中铜丝在硝酸银溶液中铜丝在硫酸铝溶液中铝丝表面覆盖一层红色的物质,溶液由蓝色变成无色(变浅)2Al+3CuSO4=Al2(SO4)3+3Cu铜丝表面覆盖一层银白色的物质,溶液由无色逐渐变成蓝色Cu+2AgNO3=Cu(NO3)2+2Ag无变化说明___的活动性强于___说明___的活动性强于___说明___的活动性强于___AlCuCuAgAlCu注:铜丝与硝酸银溶液反应开始在铜丝上附着黑色固体,颜色短时间不变讨论:1、上述能发生反应的化学方程式的特点是什么?他们属于那种反应类型?均为一种单质与一种化合物反应,生成另一种单质和化合物的反应。属于置换反应2、通过上述实验,你能得出铝、铜、银的金属活动性顺序吗?AlCuAg结论:金属活动性。由强到弱结论:1、部分金属能与金属化合物的溶液反应;金属+金属化合物新金属+新化合物2、判断金属活动性的方法之三:可根据金属能不能把另一种金属从金属化合物的溶液中置换出来,判断金属活动性的强弱。想一想:1.在金属活动性顺序里:金属的位置越______,它的活动性就越强。靠前2.通过实验一,你能得出,在金属活动性顺序里:位于____前面的金属能置换出盐酸、稀硫酸中的_____。氢氢3.通过实验二,你能得出,在金属活动性顺序里:位于_____的金属能把位于____的金属从它们的化合物的_____里置换出来。后面溶液前面(K、Ca、Na除外!)金属活动顺序性的应用1.在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。2.在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢。3.在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们化合物的溶液(盐)里置换出...