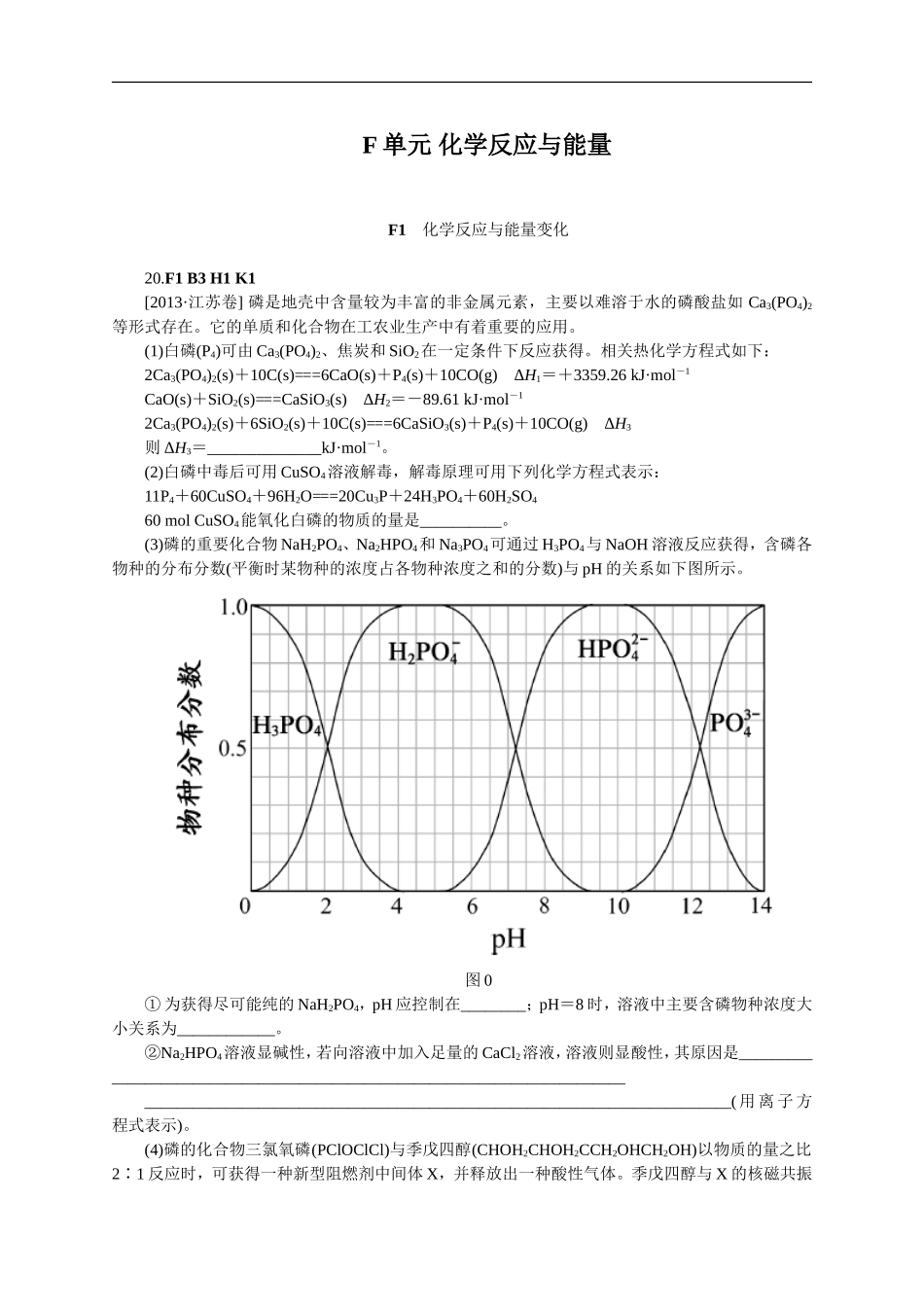
F单元化学反应与能量F1化学反应与能量变化20.F1B3H1K1[2013·江苏卷]磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:2Ca3(PO4)2(s)+10C(s)===6CaO(s)+P4(s)+10CO(g)ΔH1=+3359.26kJ·mol-1CaO(s)+SiO2(s)===CaSiO3(s)ΔH2=-89.61kJ·mol-12Ca3(PO4)2(s)+6SiO2(s)+10C(s)===6CaSiO3(s)+P4(s)+10CO(g)ΔH3则ΔH3=______________kJ·mol-1。(2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:11P4+60CuSO4+96H2O===20Cu3P+24H3PO4+60H2SO460molCuSO4能氧化白磷的物质的量是__________。(3)磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图所示。图0①为获得尽可能纯的NaH2PO4,pH应控制在________;pH=8时,溶液中主要含磷物种浓度大小关系为____________。②Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是________________________________________________________________________________________________________________________________________________(用离子方程式表示)。(4)磷的化合物三氯氧磷(PClOClCl)与季戊四醇(CHOH2CHOH2CCH2OHCH2OH)以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢谱如下图所示。图0①酸性气体是____________(填化学式)。②X的结构简式为________________。20.[答案](1)2821.6(2)3mol(3)①4~5.5(介于此区间内的任意值或区间均可)c(HPO)>c(H2PO)②3Ca2++2HPO===Ca3(PO4)2↓+2H+(4)①HCl②POClOOCH2CCH2CH2OPOClOCH27.E3F1[2013·安徽卷]我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:HCHO+O2――→CO2+H2O。下列有关说法正确的是()A.该反应为吸热反应B.CO2分子中的化学键为非极性键C.HCHO分子中既含σ键又含π键D.每生成1.8gH2O消耗2.24LO27.C11.F1F2F3[2013·福建卷]某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO。其过程如下:mCeO2――→(m-x)CeO2·xCe+xO2(m-x)CeO2·xCe+xH2O+xCO2――→mCeO2+xH2+xCO下列说法不正确的是(...