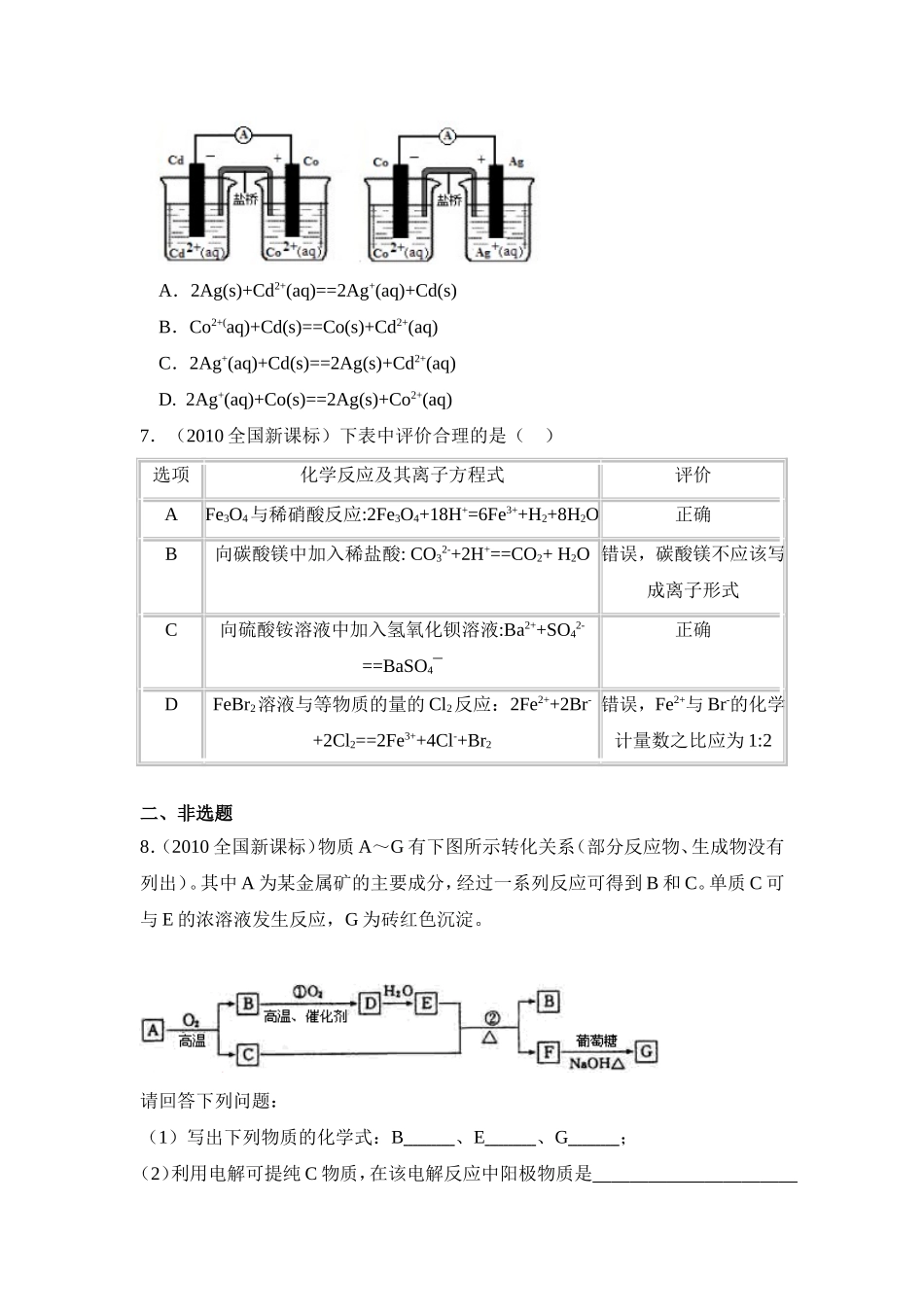
2010年高考全国新课标(宁夏、吉林、黑龙江)理综化学试卷一、选择题1.(2010全国新课标)下列各项表达中正确的是()A.Na2O2的电子式为B.106g的乙醇和丙醇混合液完全燃烧生成的CO2为112L(标准状况)C.在氮原子中,质子数为7而中子数不一定为7D.Cl-的结构示意图为2.(2010新课标)分子式为C3H6Cl2的同分异构体共有(不考虑立体异构)()A.3种B.4种C.5种D.6种3.(2010全国新课标)下列各组中的反应,属于同一反应类型的是()A.由溴丙烷水解制丙醇;由丙烯与水反应制丙醇B.由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸C.由氯代环己烷消去制环己烯;由丙烯加溴制1,2-二溴丙烷D.由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇4.(2010全国新课标)把500mL有BaCl2和KCl的混合溶液分成5等份,取一份加入含amol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为()A.0.1(b-2a)mol/LB.10(2a-b)mol/LC.10(b-a)mol/LD.10(b-2a)mol/L5.(2010全国新课标)己知:HCN(aq)与NaOH(aq)反应的∆H=-12.1kJ/mol;HCl(aq)与NaOH(aq)反应的∆H=-55.6kJ/mol。则HCN在水溶液中电离的∆H等于()A.-67.7kJ/molB.-43.5kJ/molC.+43.5kJ/molD.+67.7kJ/mol6.(2010全国新课标)根据下图,可判断出下列离子方程式中错误的是()A.2Ag(s)+Cd2+(aq)==2Ag+(aq)+Cd(s)B.Co2+(aq)+Cd(s)==Co(s)+Cd2+(aq)C.2Ag+(aq)+Cd(s)==2Ag(s)+Cd2+(aq)D.2Ag+(aq)+Co(s)==2Ag(s)+Co2+(aq)7.(2010全国新课标)下表中评价合理的是()选项化学反应及其离子方程式评价AFe3O4与稀硝酸反应:2Fe3O4+18H+=6Fe3++H2+8H2O正确B向碳酸镁中加入稀盐酸:CO32-+2H+==CO2+H2O错误,碳酸镁不应该写成离子形式C向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42-==BaSO4¯正确DFeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2==2Fe3++4Cl-+Br2错误,Fe2+与Br-的化学计量数之比应为1:2二、非选题8.(2010全国新课标)物质A~G有下图所示转化关系(部分反应物、生成物没有列出)。其中A为某金属矿的主要成分,经过一系列反应可得到B和C。单质C可与E的浓溶液发生反应,G为砖红色沉淀。请回答下列问题:(1)写出下列物质的化学式:B、E、G;(2)利用电解可提纯C物质,在该电解反应中阳极物质是,阴极物质是,电解质溶液是;(3)反应②的化学方程式是。(4)将0.23molB和0.11mol氧气放入容积为1L的密闭容器...