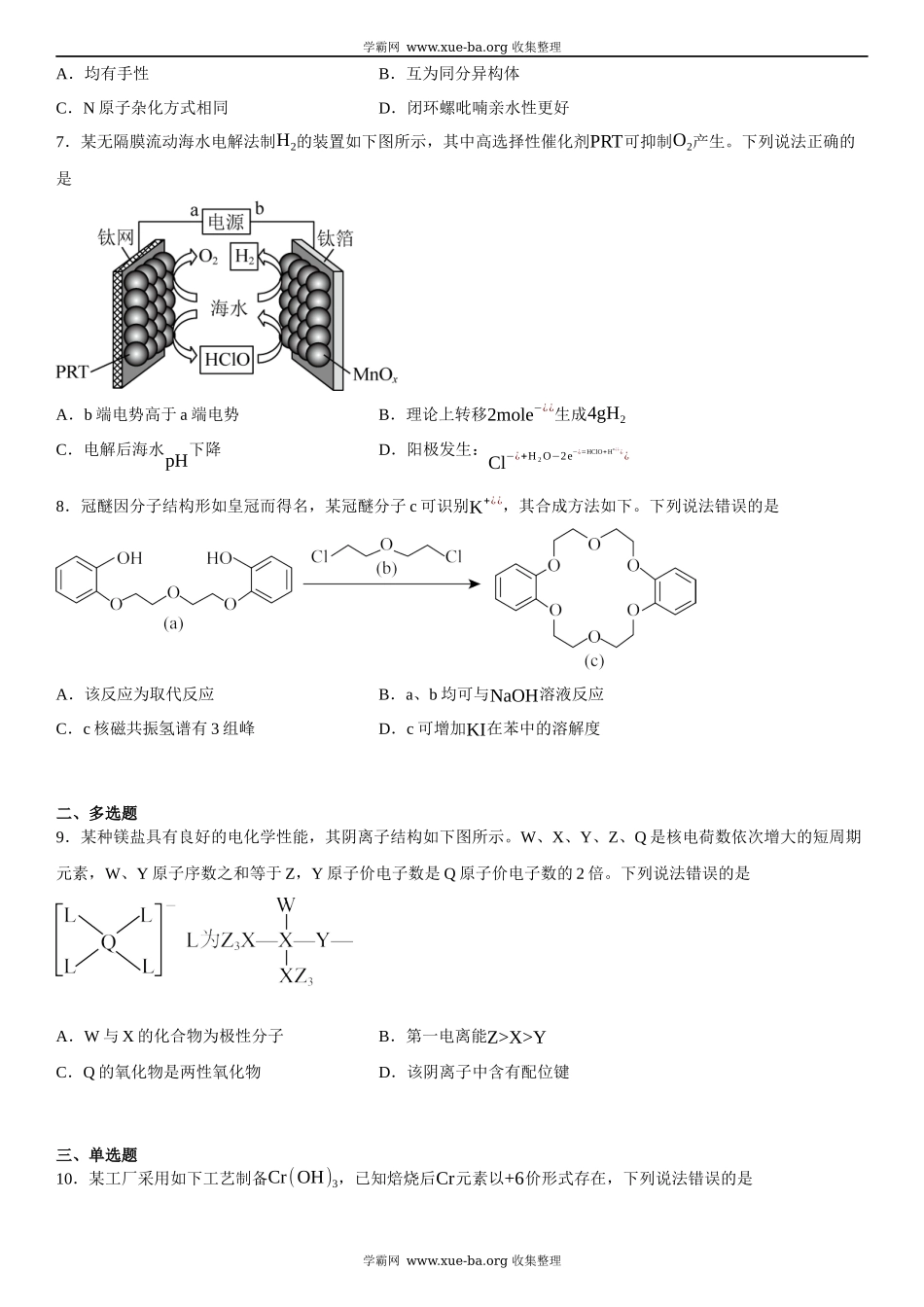
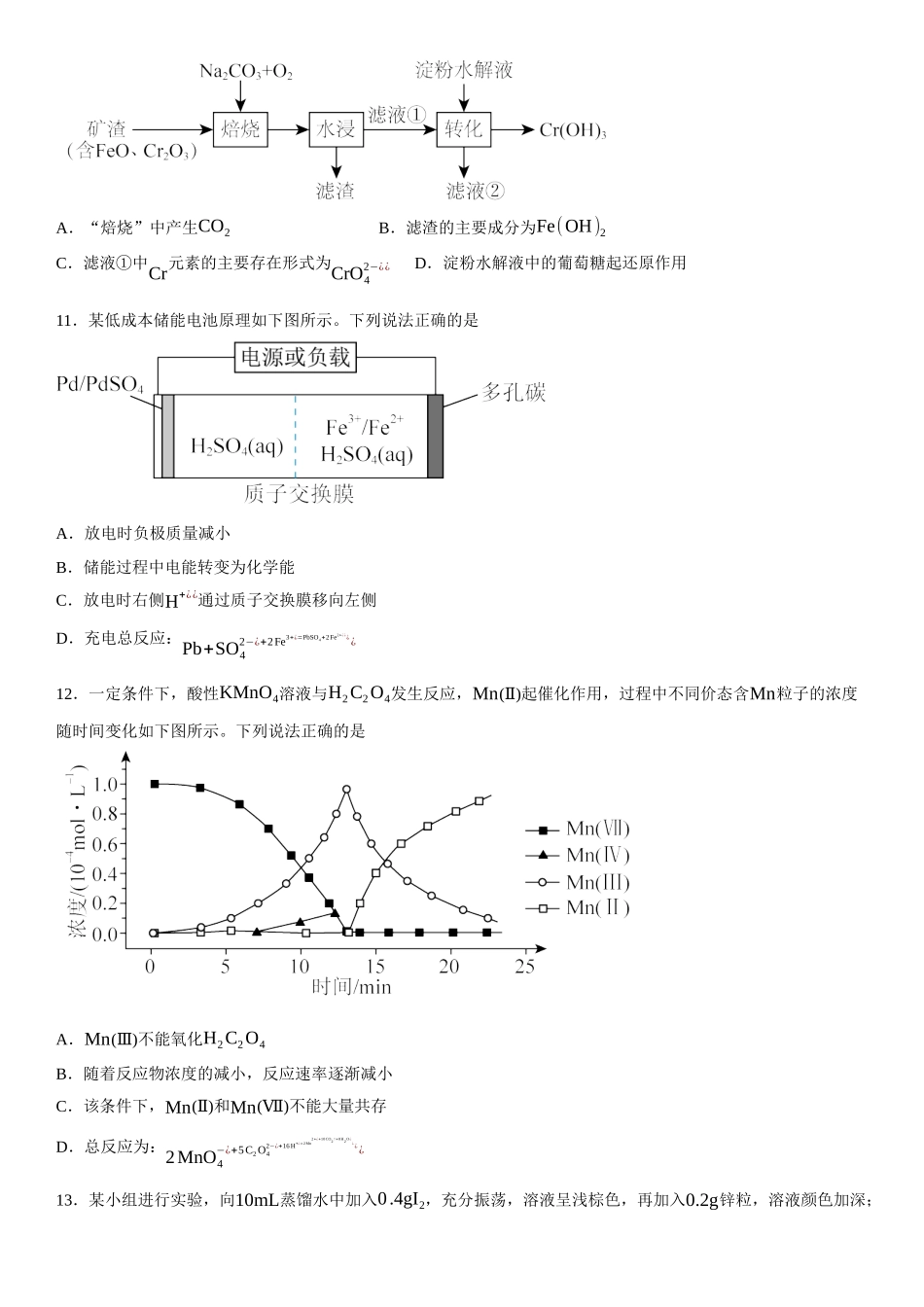
2023年高考辽宁卷化学真题学校:___________姓名:___________班级:___________考号:___________一、单选题1.科技是第一生产力,我国科学家在诸多领域取得新突破,下列说法错误的是A.利用CO2合成了脂肪酸:实现了无机小分子向有机高分子的转变B.发现了月壤中的“嫦娥石[(Ca8Y)Fe(PO4)7]”:其成分属于无机盐C.研制了高效率钙钛矿太阳能电池,其能量转化形式:太阳能→电能D.革新了海水原位电解制氢工艺:其关键材料多孔聚四氟乙烯耐腐蚀2.下列化学用语或表述正确的是A.BeCl2的空间结构:V形B.P4中的共价键类型:非极性键C.基态Ni原子价电子排布式:3d10D.顺—2—丁烯的结构简式:3.下列有关物质的工业制备反应错误的是A.合成氨:N2+3H2⇌催化剂高温、高压2NH3B.制HCl:H2+Cl2点燃¿¿2HClC.制粗硅:SiO2+2C高温¿¿Si+2COD.冶炼镁:2MgO(熔融)电解¿¿2Mg+O2↑4.下列鉴别或检验不能达到实验目的的是A.用石灰水鉴别Na2CO3与NaHCO3B.用KSCN溶液检验FeSO4是否变质C.用盐酸酸化的BaCl2溶液检验Na2SO3是否被氧化D.加热条件下用银氨溶液检验乙醇中是否混有乙醛5.我国古代四大发明之一黑火药的爆炸反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑。设NA为阿伏加德罗常数的值,下列说法正确的是A.11.2LCO2含π键数目为NAB.每生成2.8gN2转移电子数目为NAC.0.1molKNO3晶体中含离子数目为0.2NAD.1L0.1mol⋅L−1K2S溶液中含S2−¿¿数目为0.1NA6.在光照下,螺呲喃发生开、闭环转换而变色,过程如下。下列关于开、闭环螺呲喃说法正确的是学霸网www.xue-ba.org收集整理学霸网www.xue-ba.org收集整理A.均有手性B.互为同分异构体C.N原子杂化方式相同D.闭环螺吡喃亲水性更好7.某无隔膜流动海水电解法制H2的装置如下图所示,其中高选择性催化剂PRT可抑制O2产生。下列说法正确的是A.b端电势高于a端电势B.理论上转移2mole−¿¿生成4gH2C.电解后海水pH下降D.阳极发生:Cl−¿+H₂O−2e−¿=HClO+H+¿¿¿¿8.冠醚因分子结构形如皇冠而得名,某冠醚分子c可识别K+¿¿,其合成方法如下。下列说法错误的是A.该反应为取代反应B.a、b均可与NaOH溶液反应C.c核磁共振氢谱有3组峰D.c可增加KI在苯中的溶解度二、多选题9.某种镁盐具有良好的电化学性能,其阴离子结构如下图所示。W、X、Y、Z、Q是核电荷数依次增大的短周期元素,W、Y原子序数之和等于Z,Y原子价电子数是Q原子价电子数的2倍。下列说法错误的是A.W与X的化合物为极性分子B.第一电离...