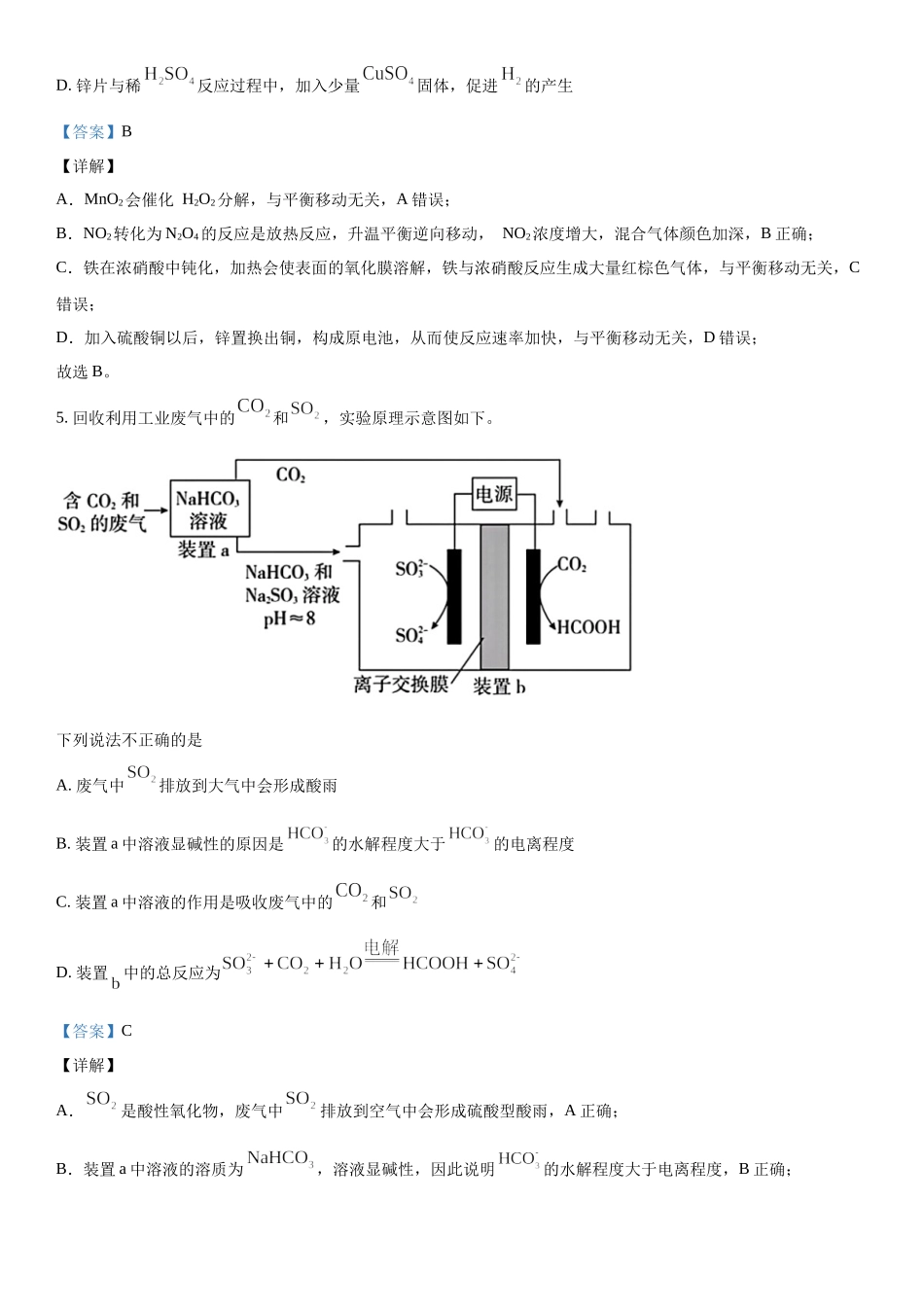
2023年普通高中学业水平等级性考试(北京卷)化学可能用到的相对原子质量:H-1C-12N-14O-16Mg-24S-32第一部分本部分共14小题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。1.中国科学家首次成功制得大面积单晶石墨炔,是碳材料科学的一大进步。下列关于金刚石、石墨、石墨炔的说法正确的是A.三种物质中均有碳碳原子间的键B.三种物质中的碳原子都是杂化C.三种物质的晶体类型相同D.三种物质均能导电【答案】A【详解】A.原子间优先形成键,三种物质中均存在键,A正确;B.金刚石中所有碳原子均采用杂化,石墨中所有碳原子均采用杂化,石墨炔中苯环上的碳原子采用杂化,碳碳三键上的碳原子采用杂化,B错误;C.金刚石为共价晶体,石墨炔为分子晶体,石墨为混合晶体,C错误;D.金刚石中没有自由移动电子,不能导电,D错误;故选A。2.下列化学用语或图示表达正确的是A.的电子式为B.的VSEPR模型为C.电子云图为D.基态原子的价层电子轨道表示式为【答案】C【详解】A.氯化钠是离子化合物,其电子式是,A错误;B.氨分子的VSEPR模型是四面体结构,B错误:C.p能级电子云是哑铃(纺锤)形,C正确;D.基态铬原子的价层电子轨道表示式是,D错误;故选C。3.下列过程与水解反应无关的是A.热的纯碱溶液去除油脂B.重油在高温、高压和催化剂作用下转化为小分子烃C.蛋白质在酶的作用下转化为氨基酸D.向沸水中滴入饱和溶液制备胶体【答案】B【详解】A.热的纯碱溶液因碳酸根离子水解显碱性,油脂在碱性条件下能水解生成易溶于水的高级脂肪酸盐和甘油,故可用热的纯碱溶液去除油脂,A错误;B.重油在高温、高压和催化剂作用下发生裂化或裂解反应生成小分子烃,与水解反应无关,B正确;C.蛋白质在酶的作用下可以发生水解反应生成氨基酸,C错误;D.Fe3+能发生水解反应生成Fe(OH)3,加热能增大Fe3+的水解程度,D错误;故选B。4.下列事实能用平衡移动原理解释的是A.溶液中加入少量固体,促进分解B.密闭烧瓶内的和的混合气体,受热后颜色加深C.铁钉放入浓中,待不再变化后,加热能产生大量红棕色气体D.锌片与稀反应过程中,加入少量固体,促进的产生【答案】B【详解】A.MnO2会催化H2O2分解,与平衡移动无关,A错误;B.NO2转化为N2O4的反应是放热反应,升温平衡逆向移动,NO2浓度增大,混合气体颜色加深,B正确;C.铁在浓硝酸中钝化,加热会使表面的氧化膜溶解,铁与浓硝酸反应生成大量红棕色气体,与平衡移动无关,C错误;D.加入硫酸铜以后,锌...