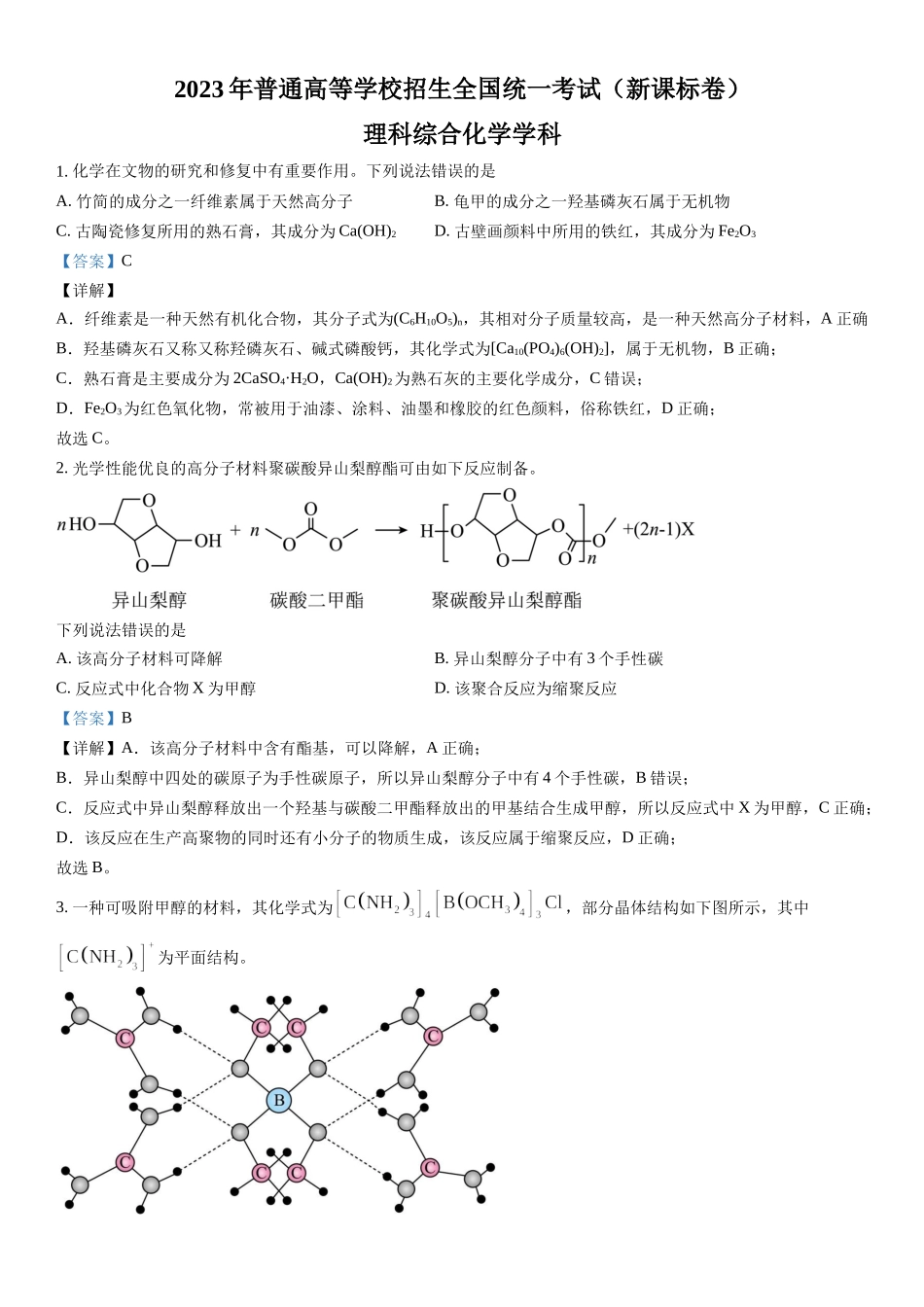
2023年普通高等学校招生全国统一考试(新课标卷)理科综合化学学科1.化学在文物的研究和修复中有重要作用。下列说法错误的是A.竹简的成分之一纤维素属于天然高分子B.龟甲的成分之一羟基磷灰石属于无机物C.古陶瓷修复所用的熟石膏,其成分为Ca(OH)2D.古壁画颜料中所用的铁红,其成分为Fe2O3【答案】C【详解】A.纤维素是一种天然有机化合物,其分子式为(C6H10O5)n,其相对分子质量较高,是一种天然高分子材料,A正确B.羟基磷灰石又称又称羟磷灰石、碱式磷酸钙,其化学式为[Ca10(PO4)6(OH)2],属于无机物,B正确;C.熟石膏是主要成分为2CaSO4·H2O,Ca(OH)2为熟石灰的主要化学成分,C错误;D.Fe2O3为红色氧化物,常被用于油漆、涂料、油墨和橡胶的红色颜料,俗称铁红,D正确;故选C。2.光学性能优良的高分子材料聚碳酸异山梨醇酯可由如下反应制备。下列说法错误的是A.该高分子材料可降解B.异山梨醇分子中有3个手性碳C.反应式中化合物X为甲醇D.该聚合反应为缩聚反应【答案】B【详解】A.该高分子材料中含有酯基,可以降解,A正确;B.异山梨醇中四处的碳原子为手性碳原子,所以异山梨醇分子中有4个手性碳,B错误;C.反应式中异山梨醇释放出一个羟基与碳酸二甲酯释放出的甲基结合生成甲醇,所以反应式中X为甲醇,C正确;D.该反应在生产高聚物的同时还有小分子的物质生成,该反应属于缩聚反应,D正确;故选B。3.一种可吸附甲醇的材料,其化学式为,部分晶体结构如下图所示,其中为平面结构。下列说法正确的是A.该晶体中存在N-H…O氢键B.基态原子的第一电离能:C.基态原子未成对电子数:D.晶体中B、N和O原子轨道的杂化类型相同【答案】A【详解】A.由晶体结构图可知,中的的与中的形成氢键,因此,该晶体中存在氢键,A正确;B.同一周期元素原子的第一电离能呈递增趋势,但是第ⅡA、ⅤA元素的原子结构比较稳定,其第一电离能高于同周期的相邻元素的原子,因此,基态原子的第一电离能从小到大的顺序为C