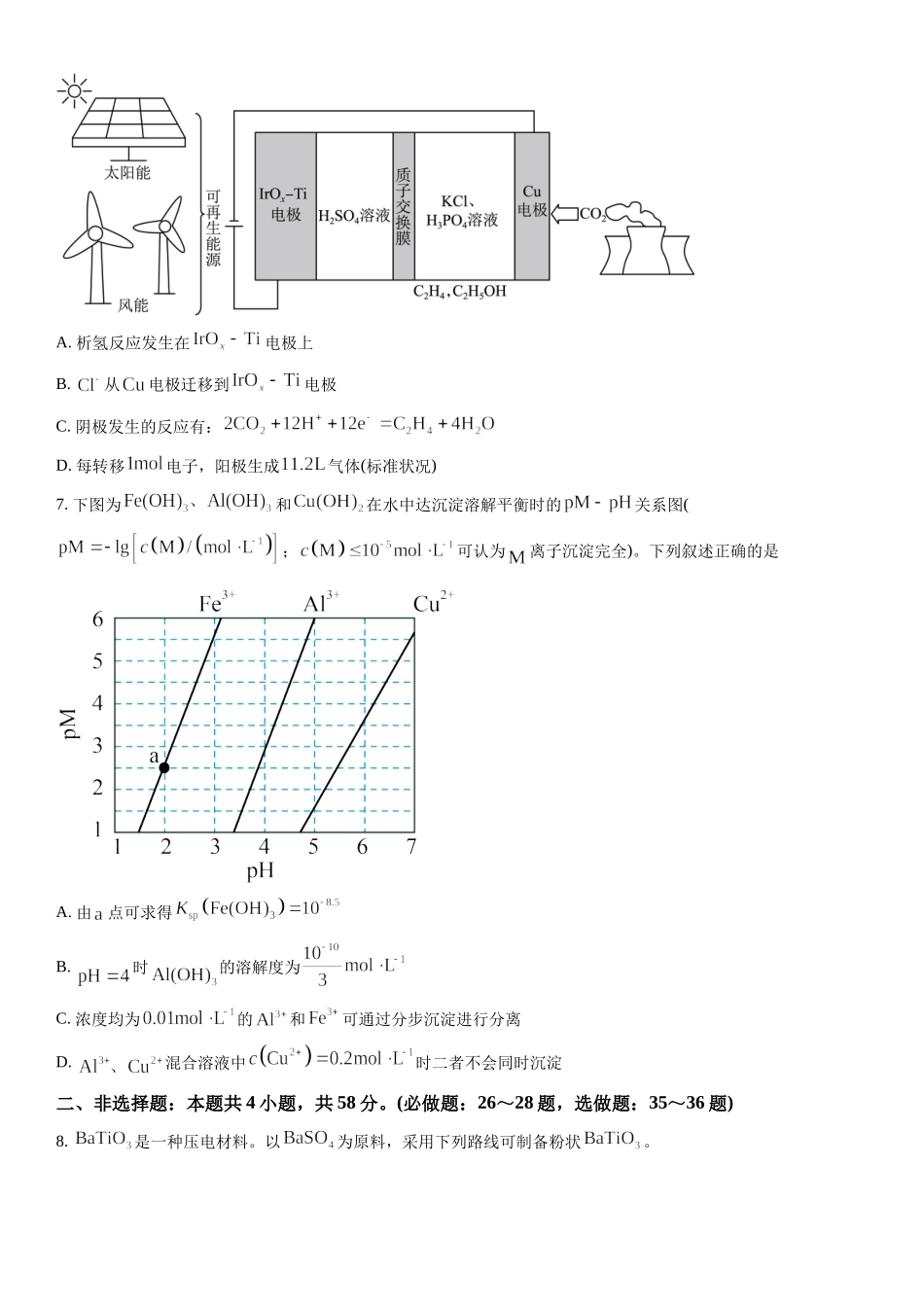
2023年普通高等学校招生全国统一考试理科综合能力测试化学部分(全国甲卷)可能用到的相对原子质量:F19Al27一、选择题:本题共13小题,每小题6分,共78分。在每小题给出的四个选项中,只有一项是符合题目要求的。(化学部分为第7~13题)1.化学与生活密切相关,下列说法正确的是A.苯甲酸钠可作为食品防腐剂是由于其具有酸性B.豆浆能产生丁达尔效应是由于胶体粒子对光线的散射C.SO2可用于丝织品漂白是由于其能氧化丝织品中有色成分D.维生素C可用作水果罐头的抗氧化剂是由于其难以被氧化2.藿香蓟具有清热解毒功效,其有效成分结构如下。下列有关该物质的说法错误的是A.可以发生水解反应B.所有碳原子处于同一平面C.含有2种含氧官能团D.能与溴水发生加成反应3.实验室将粗盐提纯并配制的溶液。下列仪器中,本实验必须用到的有①天平②温度计③坩埚④分液漏斗⑤容量瓶⑥烧杯⑦滴定管⑧酒精灯A.①②④⑥B.①④⑤⑥C.②③⑦⑧D.①⑤⑥⑧4.为阿伏加德罗常数的值。下列叙述正确的是A.异丁烷分子中共价键的数目为B.标准状况下,中电子的数目为C.的溶液中的数目为D.的溶液中的数目为5.W、X、Y、Z为短周期主族元素,原子序数依次增大,最外层电子数之和为19。Y的最外层电子数与其K层电子数相等,WX2是形成酸雨的物质之一。下列说法正确的是A.原子半径:B.简单氢化物的沸点:C.与可形成离子化合物D.的最高价含氧酸是弱酸6.用可再生能源电还原时,采用高浓度的抑制酸性电解液中的析氢反应来提高多碳产物(乙烯、乙醇等)的生成率,装置如下图所示。下列说法正确的是A.析氢反应发生在电极上B.从电极迁移到电极C.阴极发生的反应有:D.每转移电子,阳极生成气体(标准状况)7.下图为和在水中达沉淀溶解平衡时的关系图(;可认为离子沉淀完全)。下列叙述正确的是A.由点可求得B.时的溶解度为C.浓度均为的和可通过分步沉淀进行分离D.混合溶液中时二者不会同时沉淀二、非选择题:本题共4小题,共58分。(必做题:26~28题,选做题:35~36题)8.是一种压电材料。以为原料,采用下列路线可制备粉状。回答下列问题:(1)“焙烧”步骤中碳粉的主要作用是_______。(2)“焙烧”后固体产物有、易溶于水的和微溶于水的。“浸取”时主要反应的离子方程式为_______。(3)“酸化”步骤应选用的酸是_______(填标号)。a.稀硫酸b.浓硫酸c.盐酸d.磷酸(4)如果焙烧后的产物直接用酸浸取,是否可行?_______,其原因是_______。(5)“沉淀”步骤中生成的化学方程式为_______。(6)“热分...