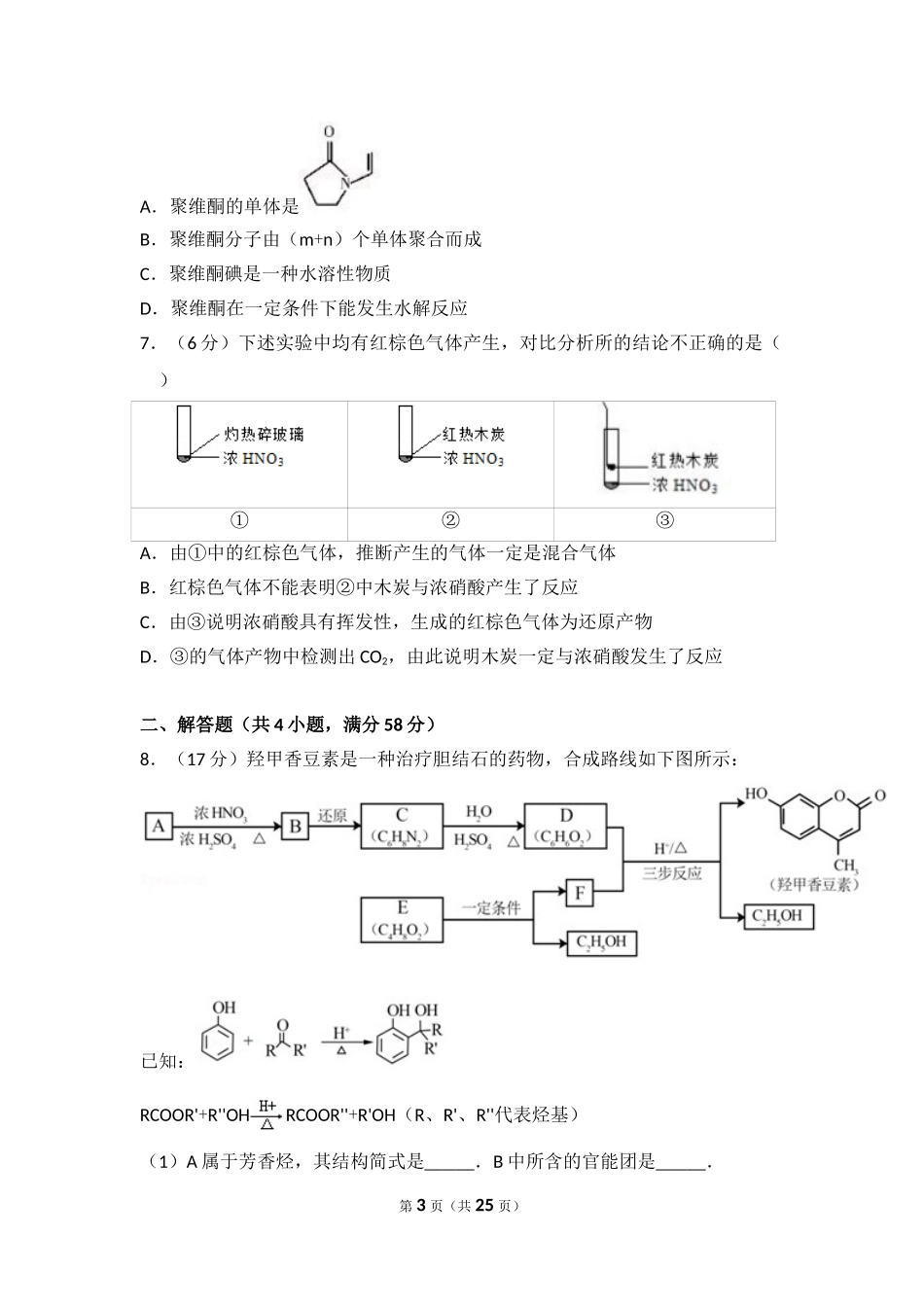
2017年北京市高考化学试卷一、本部分共7小题,每小题6分,共42分.在每小题列出的四个选项中,选出最符合题目要求的一项.1.(6分)古丝绸之路贸易中的下列商品,主要成分属于无机物的是()A.瓷器B.丝绸C.茶叶D.中草药2.(6分)2016年IUPAC命名117号元素为Ts(中文名“”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是()A.Ts是第七周期第ⅦA族元素B.Ts的同位素原子具有相同的电子数C.Ts在同族元素中非金属性最弱D.中子数为176的Ts核素符号是Ts3.(6分)下列变化中,气体被还原的是()A.二氧化碳使Na2O2固体变白B.氯气使KBr溶液变黄C.乙烯使Br2的四氯化碳溶液褪色第1页(共25页)D.氨气使AlCl3溶液产生白色沉淀4.(6分)我国在CO2催化加氢制取汽油方面取得突破性进展,CO2转化过程示意图如下:下列说法不正确的是()A.反应①的产物中含有水B.反应②中只有碳碳键形成C.汽油主要是C5~C11的烃类混合物D.图中a的名称是2﹣甲基丁烷5.(6分)根据SO2通入不同溶液中实验现象,所得结论不正确的是()实验现象结论A含HCl、BaCl2的FeCl3溶液产生白色沉淀SO2有还原性BH2S溶液产生黄色沉淀SO2有氧化性C酸性KMnO4溶液紫色溶液褪色SO2有漂白性DNa2SiO3溶液产生胶状沉淀酸性:H2SO3>H2SiO3A.AB.BC.CD.D6.(6分)聚维酮碘的水溶液是一种常见的碘伏类缓释消毒剂,聚维酮通过氢键与HI3形成聚维酮碘,其结构表示如下(图中虚线表示氢键)下列说法不正确的是()第2页(共25页)A.聚维酮的单体是B.聚维酮分子由(m+n)个单体聚合而成C.聚维酮碘是一种水溶性物质D.聚维酮在一定条件下能发生水解反应7.(6分)下述实验中均有红棕色气体产生,对比分析所的结论不正确的是()①②③A.由①中的红棕色气体,推断产生的气体一定是混合气体B.红棕色气体不能表明②中木炭与浓硝酸产生了反应C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应二、解答题(共4小题,满分58分)8.(17分)羟甲香豆素是一种治疗胆结石的药物,合成路线如下图所示:已知:RCOOR'+R''OHRCOOR''+R'OH(R、R'、R''代表烃基)(1)A属于芳香烃,其结构简式是.B中所含的官能团是.第3页(共25页)(2)C→D的反应类型是.(3)E属于酯类.仅以乙醇为有机原料,选用必要的无机试剂合成E,写出有关化学方程式:.(4)已知:2EF+C2H5OH.F所含官能团有和.(5)以D和F为原...