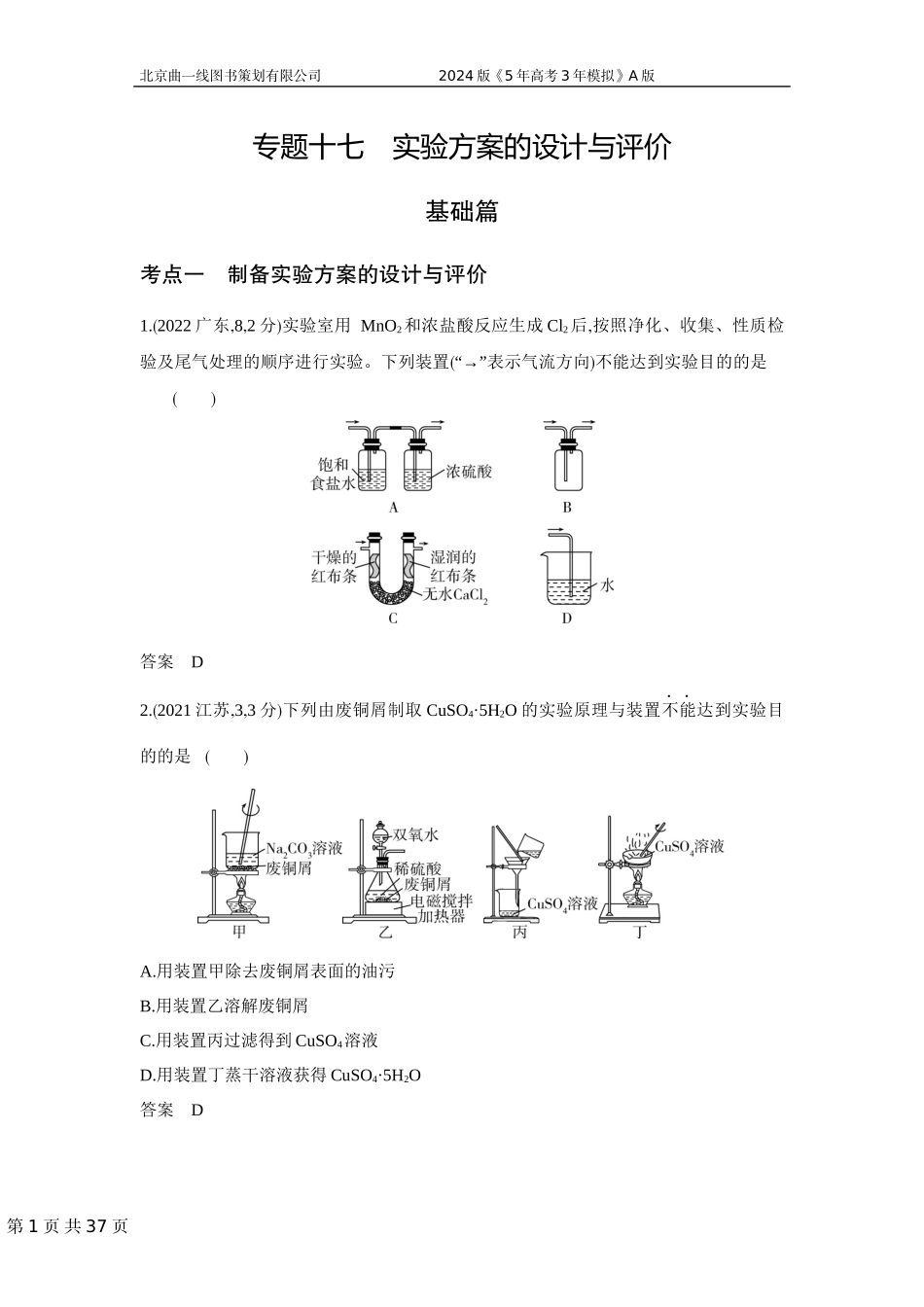
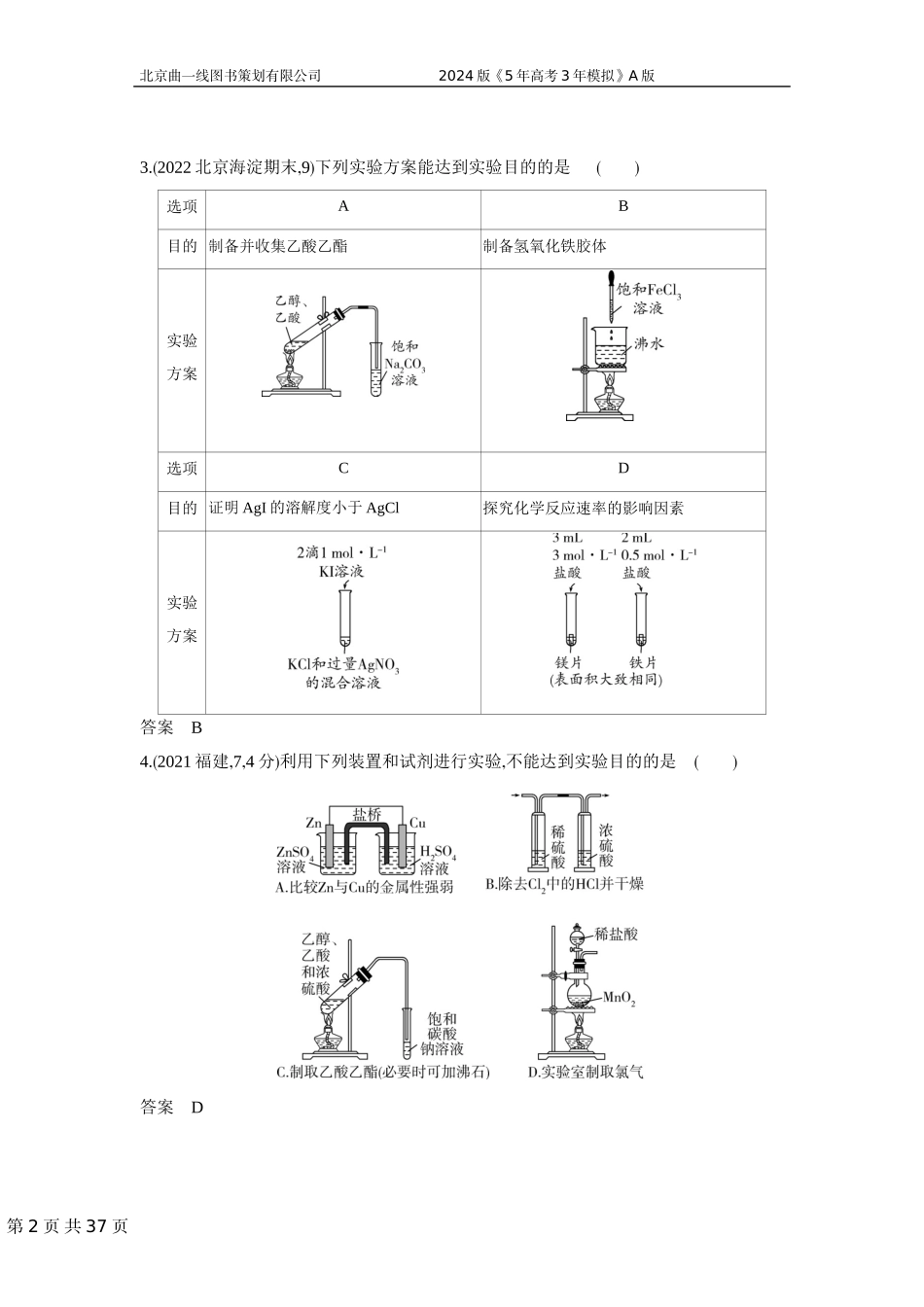
第1页共37页北京曲一线图书策划有限公司2024版《5年高考3年模拟》A版专题十七实验方案的设计与评价基础篇考点一制备实验方案的设计与评价1.(2022广东,8,2分)实验室用MnO2和浓盐酸反应生成Cl2后,按照净化、收集、性质检验及尾气处理的顺序进行实验。下列装置(“→”表示气流方向)不能达到实验目的的是()答案D2.(2021江苏,3,3分)下列由废铜屑制取CuSO4·5H2O的实验原理与装置不能达到实验目的的是()A.用装置甲除去废铜屑表面的油污B.用装置乙溶解废铜屑C.用装置丙过滤得到CuSO4溶液D.用装置丁蒸干溶液获得CuSO4·5H2O答案D第2页共37页北京曲一线图书策划有限公司2024版《5年高考3年模拟》A版3.(2022北京海淀期末,9)下列实验方案能达到实验目的的是()选项AB目的制备并收集乙酸乙酯制备氢氧化铁胶体实验方案选项CD目的证明AgI的溶解度小于AgCl探究化学反应速率的影响因素实验方案答案B4.(2021福建,7,4分)利用下列装置和试剂进行实验,不能达到实验目的的是()答案D第3页共37页北京曲一线图书策划有限公司2024版《5年高考3年模拟》A版5.(2023届湖北枣阳一中9月月考,13)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用Al和氯气通过下列装置制备。已知A中产生的氯气混有少许HCl和水蒸气。下列说法正确的是()A.试剂瓶B、C、F中分别盛饱和NaHCO3、浓硫酸、浓硫酸B.氯化铝产品最后在装置E中收集C.实验开始时应先点燃D中酒精灯D.装置F和G可用盛无水CaCl2的干燥管替换答案B6.(2022山西太原三模,11)氮化钡(Ba3N2)是一种重要的化学试剂。高温下,向氢化钡(BaH2)中通入氮气反应生成氮化钡,在实验室可用如图装置制备(每个装置只用一次)。已知:Ba3N2遇水反应;BaH2在潮湿空气中能自燃,遇水反应。下列说法不正确的是()甲乙丙丁A.实验时,先点燃装置丙中的酒精喷灯,后点燃装置乙中的酒精灯B.该实验装置中缺少尾气处理装置C.按气流方向,装置的连接顺序可为c→b→a→d→e→gD.装置甲中的浓硫酸和装置丁中的碱石灰均可防止水蒸气进入装置丙中答案A7.(2019课标Ⅲ,12,6分)下列实验不能达到目的的是()选项目的实验第4页共37页北京曲一线图书策划有限公司2024版《5年高考3年模拟》A版A制取较高浓度的次氯酸溶液将Cl2通入碳酸钠溶液中B加快氧气的生成速率在过氧化氢溶液中加入少量MnO2C除去乙酸乙酯中的少量乙酸加入饱和碳酸钠溶液洗涤、分液D制备少量二氧化硫气体向饱和亚硫酸钠溶液中滴加浓硫酸答案A8.(2021广东,12,4分)化学是以实验为基础的科学。下列实验操作或做法正...