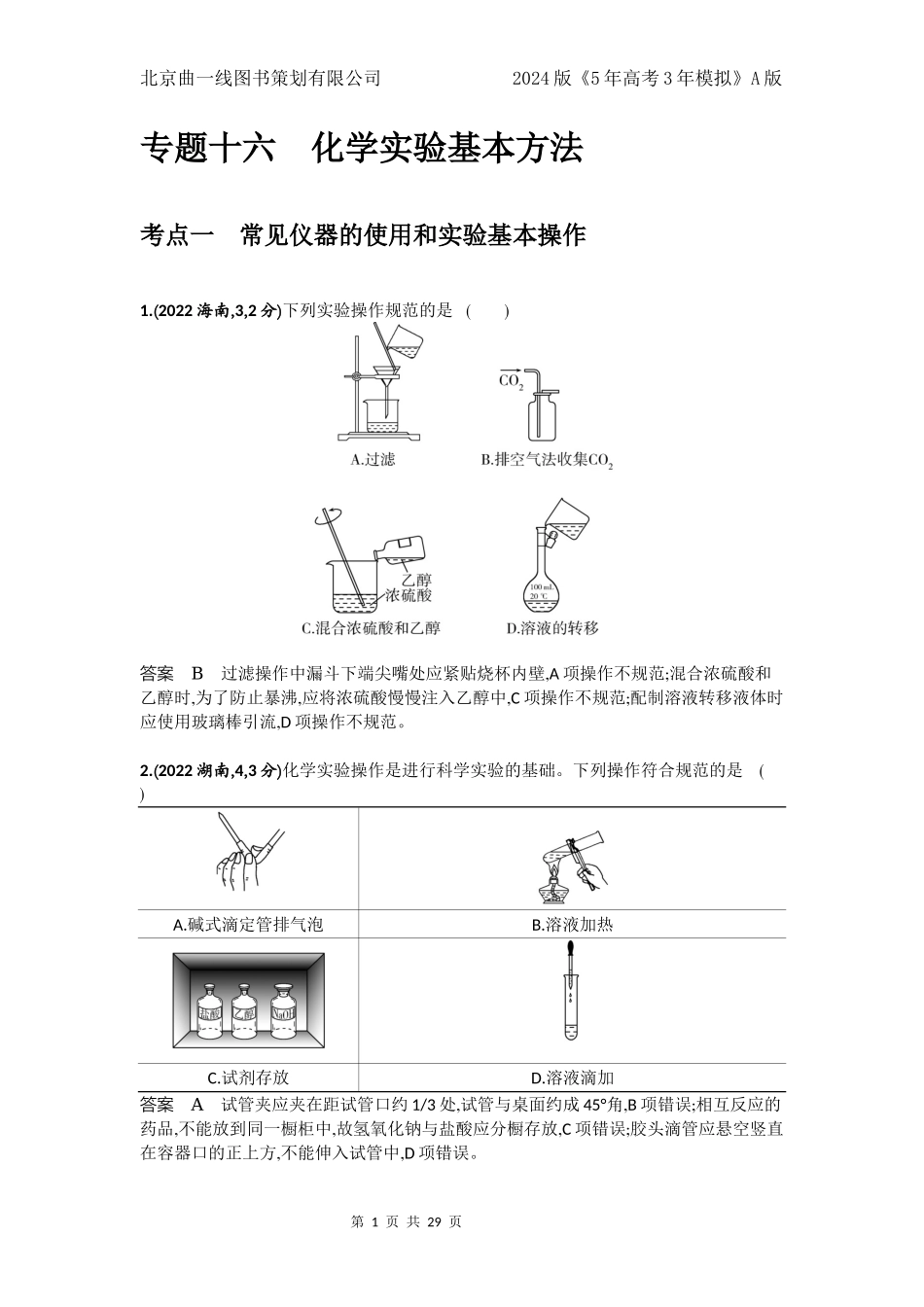
第1页共29页北京曲一线图书策划有限公司2024版《5年高考3年模拟》A版专题十六化学实验基本方法考点一常见仪器的使用和实验基本操作1.(2022海南,3,2分)下列实验操作规范的是()答案B过滤操作中漏斗下端尖嘴处应紧贴烧杯内壁,A项操作不规范;混合浓硫酸和乙醇时,为了防止暴沸,应将浓硫酸慢慢注入乙醇中,C项操作不规范;配制溶液转移液体时应使用玻璃棒引流,D项操作不规范。2.(2022湖南,4,3分)化学实验操作是进行科学实验的基础。下列操作符合规范的是()A.碱式滴定管排气泡B.溶液加热C.试剂存放D.溶液滴加答案A试管夹应夹在距试管口约1/3处,试管与桌面约成45°角,B项错误;相互反应的药品,不能放到同一橱柜中,故氢氧化钠与盐酸应分橱存放,C项错误;胶头滴管应悬空竖直在容器口的正上方,不能伸入试管中,D项错误。第2页共29页北京曲一线图书策划有限公司2024版《5年高考3年模拟》A版3.(2022山东,2,2分)下列试剂实验室保存方法错误的是()A.浓硝酸保存在棕色细口瓶中B.氢氧化钠固体保存在广口塑料瓶中C.四氯化碳保存在广口塑料瓶中D.高锰酸钾固体保存在棕色广口瓶中答案C硝酸见光易分解,浓硝酸需在棕色细口瓶中避光保存,A项正确;氢氧化钠能与SiO2反应,可保存于广口塑料瓶中,B项正确;塑料是有机物,能溶于有机溶剂四氯化碳,C项错误;光可催化高锰酸钾分解,需保存于棕色广口瓶中,D项正确。知识归纳药品存放:固体药品存放于广口瓶中,液体药品存放于细口瓶中;见光易分解的物质应存放于棕色试剂瓶中,如硝酸银、浓硝酸等。4.(2022浙江1月选考,3,2分)名称为“干燥管”的仪器是()答案BA为蒸馏烧瓶,B为干燥管,C为冷凝管,D为分液漏斗。11.(2022浙江6月选考,11,2分)下列说法不正确的是()A.用标准液润洗滴定管后,应将润洗液从滴定管上口倒出B.铝热反应非常剧烈,操作时要戴上石棉手套和护目镜C.利用红外光谱法可以初步判断有机物中具有哪些基团D.蒸发浓缩硫酸铵和硫酸亚铁(等物质的量)的混合溶液至出现晶膜,静置冷却,析出硫酸亚铁铵晶体答案A用标准液润洗滴定管时,润洗液应从下端流出,不能从上口倒出,A错误。温馨提示铝和金属氧化物在高温下发生剧烈反应并放出大量热的化学反应称作铝热反应。5.(2016北京理综,7,6分)下列中草药煎制步骤中,属于过滤操作的是()A.冷水浸泡B.加热煎制C.箅渣取液D.灌装保存答案CA项属于溶解;B项属于溶解和浓缩;D项则属于液体的转移。第3页共29页北京曲一线图书策划有限公司2024版《5年高考3年模拟》A版6.(2015山东理综,7,5分)进行化学实验时应强化安...