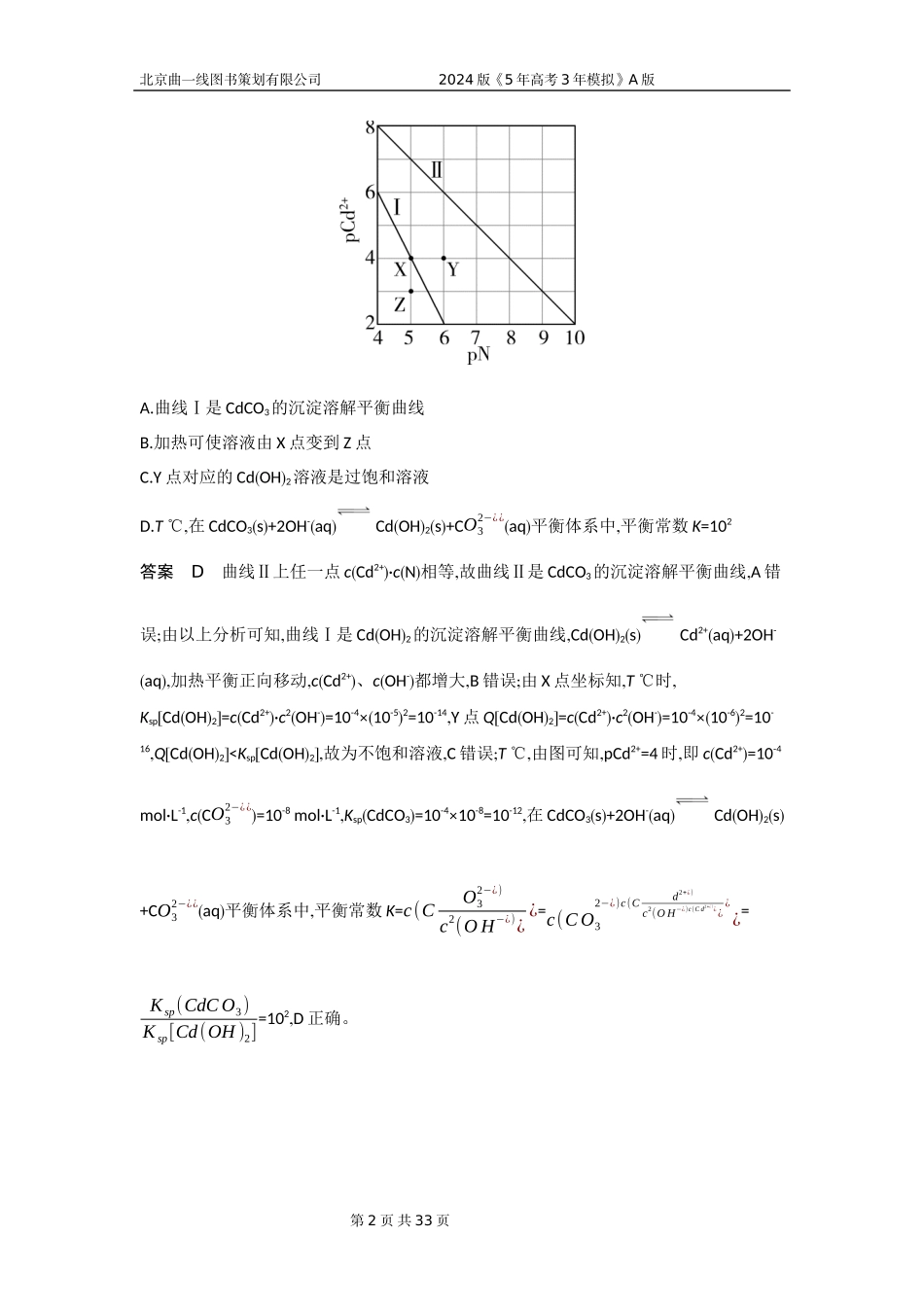
第1页共33页北京曲一线图书策划有限公司2024版《5年高考3年模拟》A版专题十三盐类的水解和沉淀溶解平衡1.下列叙述不涉及盐类水解的是()A.保存FeSO4溶液时加入少量铁屑B.用NH4Cl溶液除铁锈C.用MgCl2·6H2O制MgCl2需在HCl气流中D.用热的纯碱溶液洗涤油污答案A加入少量铁屑,可防止FeSO4溶液中Fe2+氧化变质,与盐类水解无关,A符合题意;NH4+¿¿水解使NH4Cl溶液呈酸性,H+可与铁锈反应达到除去铁锈的目的,B项不符合题意;在HCl气氛中加热可防止MgCl2水解,C项不符合题意;碳酸钠是强碱弱酸盐,其溶液呈碱性,能促进油脂水解,D项不符合题意。2.已知物质的溶度积常数:Ksp(FeS)=6.3×10-18,Ksp(CuS)=6.3×10-36。下列说法正确的是()A.相同温度下,CuS的溶解度大于FeS的溶解度B.除去工业废水中的Cu2+,可以选用FeS作沉淀剂C.相同温度下,向饱和FeS溶液中加入少量Na2S固体后,Ksp(FeS)变小D.向等浓度的FeCl2和CuCl2混合溶液中逐滴加入Na2S溶液,最先出现的沉淀是FeS答案BCuS和FeS类型相同,Ksp(CuS)