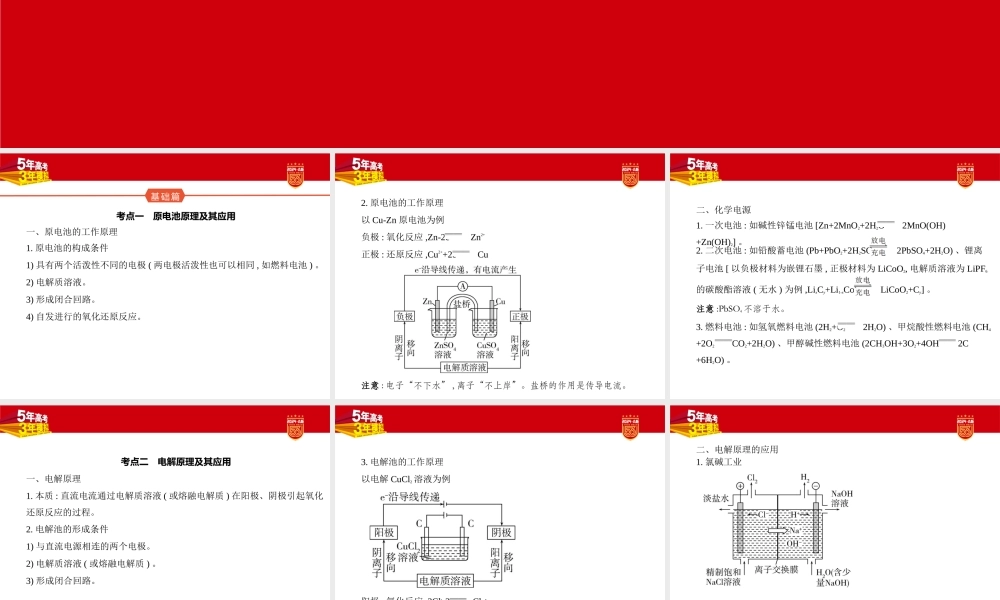
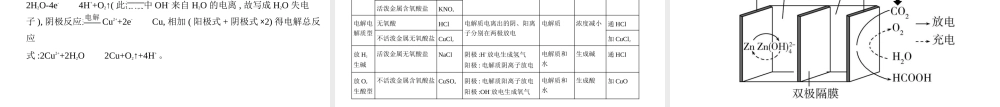
高考化学新高考专用专题十化学反应与电能考点一原电池原理及其应用基础篇一、原电池的工作原理1.原电池的构成条件1)具有两个活泼性不同的电极(两电极活泼性也可以相同,如燃料电池)。2)电解质溶液。3)形成闭合回路。4)自发进行的氧化还原反应。2.原电池的工作原理以Cu-Zn原电池为例负极:氧化反应,Zn-2e-Zn2+正极:还原反应,Cu2++2e-Cu注意:电子“不下水”,离子“不上岸”。盐桥的作用是传导电流。二、化学电源1.一次电池:如碱性锌锰电池[Zn+2MnO2+2H2O2MnO(OH)+Zn(OH)2]。2.二次电池:如铅酸蓄电池(Pb+PbO2+2H2SO42PbSO4+2H2O)、锂离子电池[以负极材料为嵌锂石墨,正极材料为LiCoO2,电解质溶液为LiPF6的碳酸酯溶液(无水)为例,LixCy+Li1-xCoO2LiCoO2+Cy]。注意:PbSO4不溶于水。3.燃料电池:如氢氧燃料电池(2H2+O22H2O)、甲烷酸性燃料电池(CH4+2O2CO2+2H2O)、甲醇碱性燃料电池(2CH3OH+3O2+4OH-2C+6H2O)。一、电解原理考点二电解原理及其应用1.本质:直流电流通过电解质溶液(或熔融电解质)在阳极、阴极引起氧化还原反应的过程。2.电解池的形成条件1)与直流电源相连的两个电极。2)电解质溶液(或熔融电解质)。3)形成闭合回路。3.电解池的工作原理以电解CuCl2溶液为例阳极:氧化反应,2Cl--2e-Cl2↑阴极:还原反应,Cu2++2e-Cu1.氯碱工业阳极:2Cl--2e-Cl2↑阴极:2H2O+2e-H2↑+2OH-总反应:2Cl-+2H2O2OH-+Cl2↑+H2↑二、电解原理的应用2.电镀阳极:镀层金属,电镀时质量减小。阴极:镀件,电镀时质量增大。电镀液:含有镀层金属离子的溶液,浓度基本不变。如在铁件上镀铜:3.铜的电解精炼阳极:粗铜,按成分还原性由强到弱依次放电,主要反应为Cu-2e-Cu2+。阴极:纯铜,Cu2++2e-Cu。电解质溶液:电解精炼过程中CuSO4溶液浓度减小。阳极泥:失电子能力比铜弱的杂质,如Au、Ag。4.电冶金利用电解熔融盐或氧化物的方法来冶炼活泼金属,如Na、Mg、Al等。2NaCl(熔融)2Na+Cl2↑MgCl2(熔融)Mg+Cl2↑2Al2O3(熔融)4Al+3O2↑一、金属的腐蚀考点三金属的腐蚀与防护1.化学腐蚀:金属与其表面接触的一些物质直接发生化学反应。2.电化学腐蚀1)本质:发生了原电池反应,不纯的金属中较活泼的金属失去电子而被氧化。吸氧腐蚀析氢腐蚀条件水膜呈弱酸性或中性水膜酸性较强负极反应2Fe-4e-2Fe2+Fe-2e-Fe2+正极反应O2+2H2O+4e-4OH-2H++2e-H2↑总反应2Fe+O2+2H2O2Fe(OH)2Fe+2H+Fe2++H2↑2)钢铁的吸氧腐蚀与析氢腐蚀3.金属腐蚀快慢的影响因素及判断原则1)影响因素:构成原电池的材料活泼性差异、金属所接触的介质...