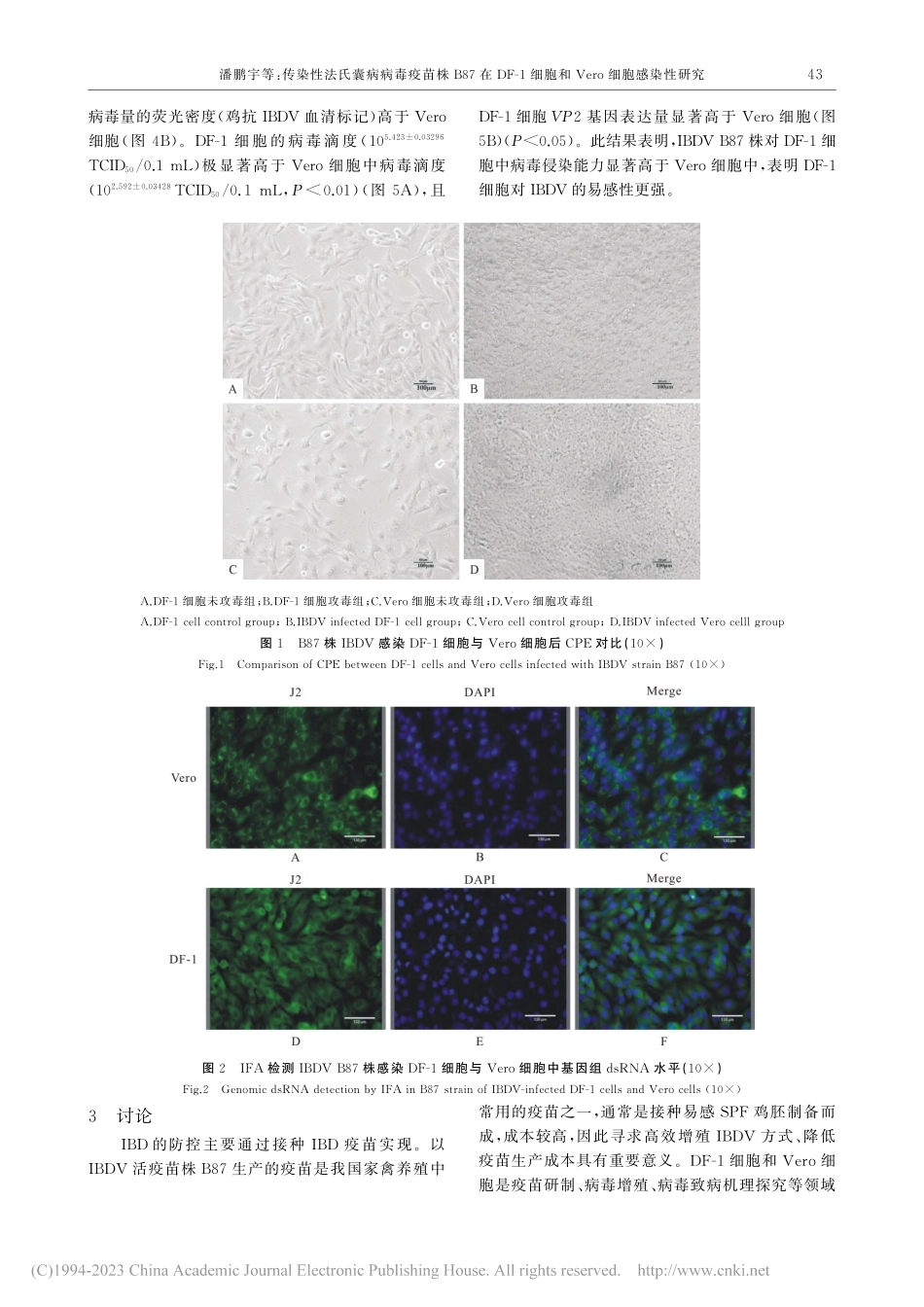
动物医学进展,2023,44(2):41-45ProgressinVeterinaryMedicine传染性法氏囊病病毒疫苗株B87在DF-1细胞和Vero细胞感染性研究收稿日期:2022-03-02基金项目:天津市教委科研计划项目(2021KJ108);天津市企业科技特派员项目(22YDTPJC00990);国家自然科学基金项目(31702223);天津市“131”创新型人才团队建设项目(20180318)作者简介:潘鹏宇(1996-),女(满族),山东武城人,硕士研究生,主要从事畜禽病毒与免疫研究。*通讯作者潘鹏宇1,韩金泽1,殷建豪1,谢艾伶1,吴凤明2,刘鼎阔3,孙英峰1,尤春雪1,于晓雪1*,李留安1*(1.天津农学院动物医学与动物科学学院天津市农业动物繁育与健康养殖重点实验室,天津300392;2.天津市广源畜禽养殖有限公司,天津301806;3.鼎正新兴生物技(天津)有限公司天津市生物饲料添加剂企业重点实验室,天津300383)摘要:为比较传染性法氏囊病病毒(Infectiousbursaldiseasevirus,IBDV)疫苗株B87对DF-1细胞和Vero细胞易感性,对比了IBDVB87株感染两种细胞后的致细胞病变效应(cytopathiceffect,CPE)、病毒基因组dsRNA、半数组织感染量(mediantissuecultureinfectivedose,TCID50)水平、病毒载量及VP2基因表达水平。结果显示,IBDVB87株感染后,DF-1细胞CPE程度高于Vero细胞;DF-1细胞病毒基因dsRNA荧光密度高于Vero细胞;DF-1细胞病毒载量荧光密度高于Vero细胞,且DF-1细胞中病毒滴度(105.423±0.03296TCID50/0.1mL)极显著高于Vero细胞中病毒滴度(102.592±0.03428TCID50/0.1mL,P<0.01),VP2基因表达量显著高于Vero细胞(P<0.05)。说明IBDVB87株对DF-1细胞的感染性高于Vero细胞。关键词:鸡传染性法氏囊病病毒B87株;DF-1细胞;Vero细胞;感染性;细胞嗜性中图分类号:S852.659.4文献标识码:A文章编号:1007-5038(2023)02-0041-05鸡传染性法氏囊病(Infectiousbursaldisease,IBD)是由IBDV引起的高度传染性的免疫抑制性疾病[1,2]。该病使3周龄~12周龄雏鸡法氏囊萎缩甚至坏死,鸡只严重免疫抑制或死亡,对世界养禽业造成威胁。疫苗接种是预防该病的最有效措施。B87株IBDV是我国广泛使用的IBDV疫苗株,该疫苗通过接种SPF鸡胚,收获感染鸡胚,经研磨、添加适宜稳定剂、冷冻真空干燥等步骤制备,但生产工艺繁杂,成本较高。DF-1细胞和Vero细胞是能无限繁殖的细胞系,广泛应用于多种病毒增殖、重组蛋白表达、动物与人类病毒病疫苗生产等领域。本试验使用IBDVB87株感染DF-1细胞和Vero细胞,利用免疫荧光法、实时荧光定量PCR等比较两种细胞对病毒的易感性,旨在为IBD疫苗规模化生产筛选合...