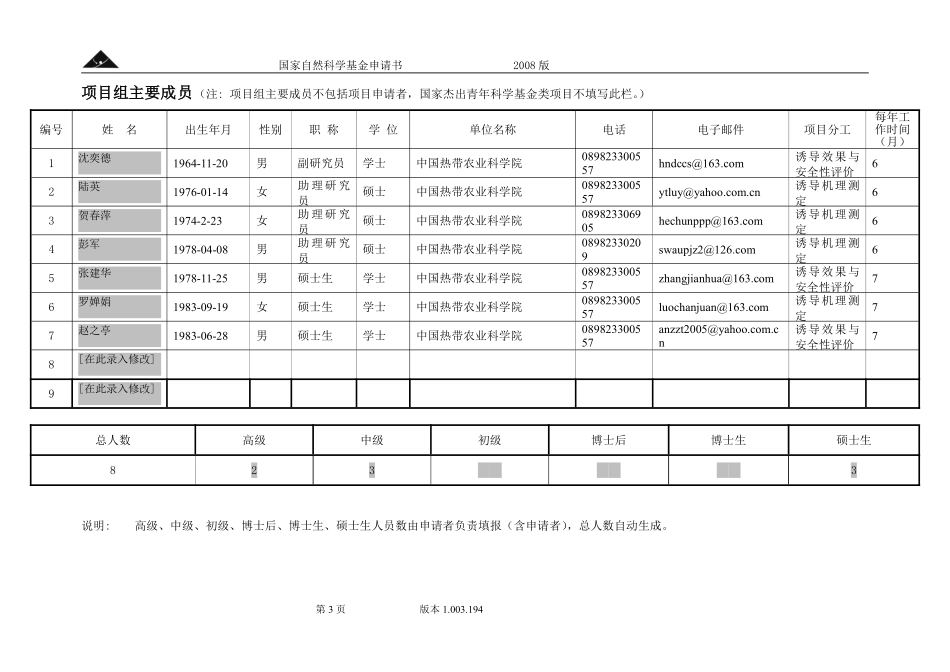
申请代码:C110408受理部门:收件日期:受理编号:解除保护国家自然科学基金申请书(2008版)资助类别:面上项目亚类说明:附注说明:项目名称:ASM诱导大豆对恶性寄生杂草菟丝子的抗性研究申请者:范志伟电话:089823300557依托单位:中国热带农业科学院通讯地址:海南省儋州市宝岛新村邮政编码:571737单位电话:0898-23300496电子邮件:fanweed@hotmail.com申报日期:2008年3月15日国家自然科学基金委员会国家自然科学基金申请书2008版第2页版本1.003.194基本信息zYleU7IM申请者信息姓名范志伟性别男出生年月1964年10月民族汉族学位博士职称副研究员主要研究领域杂草学与植物诱导抗性电话089823300557电子邮件fanweed@hotmail.com传真089823300557个人网页工作单位中国热带农业科学院/环境与植物保护研究所在研项目批准号依托单位信息名称中国热带农业科学院代码57173701联系人宋红艳电子邮件23300496@163.com电话0898-23300496网站地址http://www.catas.cn合作单位信息单位名称代码[在此录入修改][在此录入修改]项目基本信息项目名称ASM诱导大豆对恶性寄生杂草菟丝子的抗性研究资助类别面上项目亚类说明附注说明申请代码C110408:杂草防治C1104:植物保护学基地类别预计研究年限2009年1月—2011年12月研究属性应用基础研究申请经费30.0000万元摘要(限400字):大豆是重要的粮食作物和主要的油料、饲料作物。茎寄生恶性杂草--菟丝子对大豆的危害逐年加重,并难以防除,已成为大豆生产的主要生物限制因子之一。植物诱导抗性不仅可以防治作物病虫害,而且也可以控制寄生性杂草。ASM(通用名:acibenzolar-S-methyl,活化脂;化学名称:苯并噻二唑)是一种新型广谱植物抗性诱导剂,能够诱导作物对病、虫、寄生杂草的抗性。本项目通过研究ASM对大豆抗性的诱导,提高大豆自身天然免疫力,控制菟丝子的危害,为作物茎寄生杂草的防除提供新途径;同时对其诱导抗性的机制进行生物化学和分子生物学研究,测定诱导抗性化合物,并利用抑制性消减杂交(SSH)技术,构建ASM诱导大豆抗性基因差异表达cDNA文库,为建立ASM诱导大豆抗性的分子生物学打下基础。本项目结合大豆的生产问题,从绿色植保入手,对拓展有害生物综合植保体系具有特别重要的理论和实际意义。关键词(用分号分开,最多5个)植物诱导抗性;大豆菟丝子;ASM;诱导效果、安全性与机理国家自然科学基金申请书2008版第3页版本1.003.194项目组主要成员(注:项目组主要成员不包括项目申请者,国家杰出青年科...