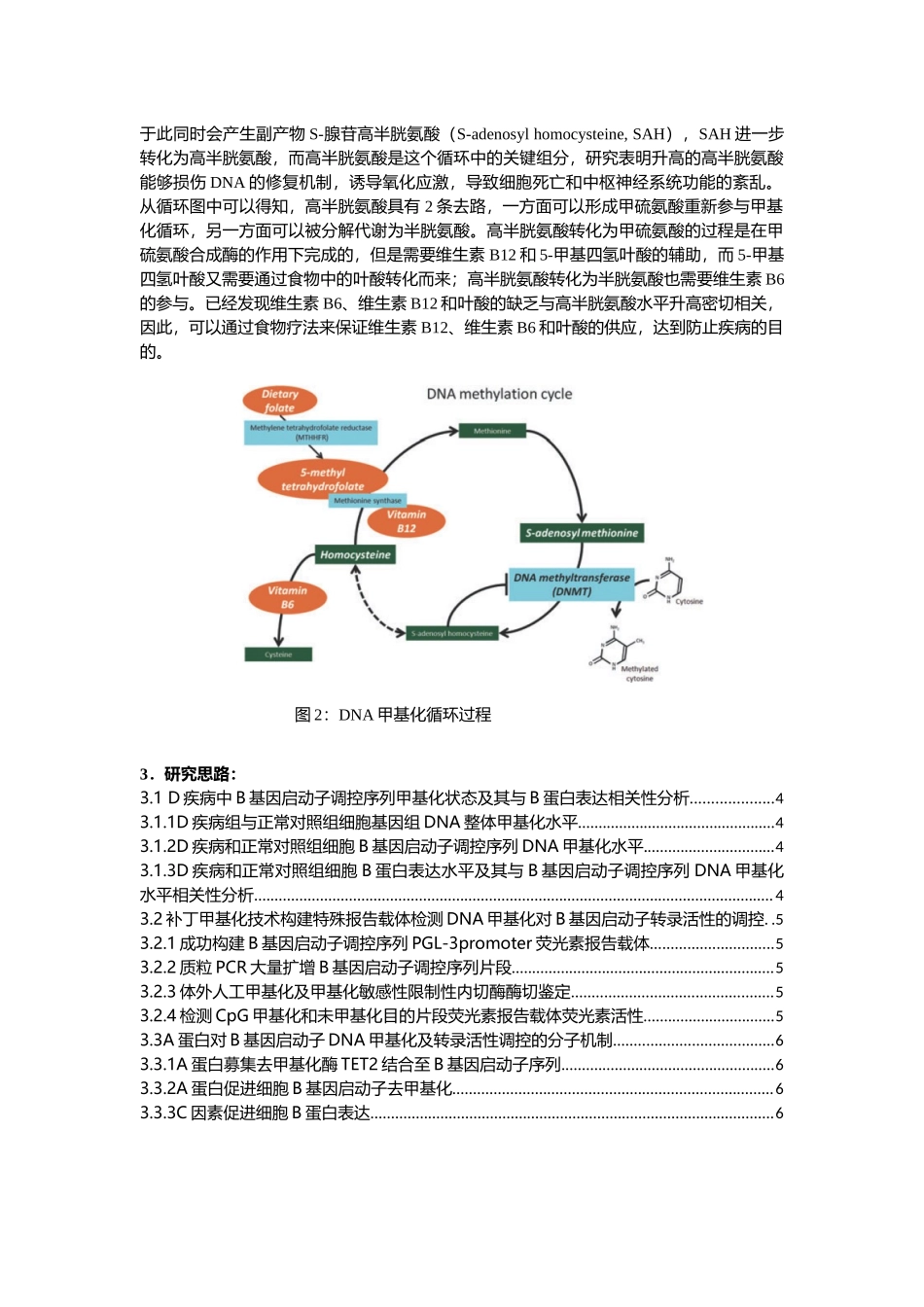
分子机制研究套路(八)DNA(羟)甲基化课题:C因素激活A蛋白对B基因启动子DNA甲基化的调控对D疾病的影响1.概念介绍:表观遗传学是当今生命科学普遍关注的前沿,是一种可遗传的调节基因表达的机制,不同于经典遗传学,不涉及到基因序列的改变,而且表观遗传修饰是可逆的,在基因调控中起重要作用。DNA甲基化是表观遗传学主要调控机制之一,在维持正常细胞功能、遗传印记、胚胎发育、染色质结构改变以及人类疾病的发生、发展中起着重要作用。DNA甲基化是指由S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)提供甲基、在DNA甲基转移酶(DNAmethyltransferase,DNMT)的催化下,在胞嘧啶的C5位上面加上一个甲基,形成5-甲基胞嘧啶(5-mC)的化学修饰过程。DNA甲基转移酶(如DNMTs)与DNA去甲基化酶(如TET蛋白等)调控基因组DNA序列甲基化的动态变化,一般来说,基因启动子区CpG岛的甲基化可以使一些转录因子无法与DNA结合而抑制基因的转录,而该区域的去甲基化则可以激活基因的转录。DNA甲基化主要发生在CpG异二核苷酸上面(如示意图1),而CpG在人类基因组中出现的几率比较低,主要集中出现在CpG岛(CpGisland)上面。CpG岛是指由200bp的碱基组成的DNA序列,其中GC含量占60%以上的一个区域,这个区域主要位于某些基因的启动子区域。CpG岛上DNA的甲基化是表观遗传学研究中的一个重点,其可改变染色体的结构、影响邻近基因的表达。高度甲基化的DNA与组蛋白结合紧密并且能够招募转录抑制因子、抑制转录激活因子与启动子区域的结合,从而达到抑制基因表达的目的;而DNA的低甲基化使得染色体结构松散,促进转录激活因子和RNA多聚酶与靶序列的结合,从而驱使相关基因的高表达。图1:DNA在CpG异二核苷酸上的甲基化示意图表观遗传学最先用于肿瘤的研究中。在许多肿瘤细胞中发现CpG岛高度甲基化,从而抑制抑癌基因的表达,诱发肿瘤的产生,因此DNMT抑制剂5-氮胞苷(5-AZA)等被用于肿瘤的临床治疗。2.示意图:DNA甲基化循环的过程如图2:通过SAM提供甲基,在DNMT的催化下完成甲基化过程,于此同时会产生副产物S-腺苷高半胱氨酸(S-adenosylhomocysteine,SAH),SAH进一步转化为高半胱氨酸,而高半胱氨酸是这个循环中的关键组分,研究表明升高的高半胱氨酸能够损伤DNA的修复机制,诱导氧化应激,导致细胞死亡和中枢神经系统功能的紊乱。从循环图中可以得知,高半胱氨酸具有2条去路,一方面可以形成甲硫氨酸重新参与甲基化循环,另一方面可以被分解代谢为半胱氨酸。高半...