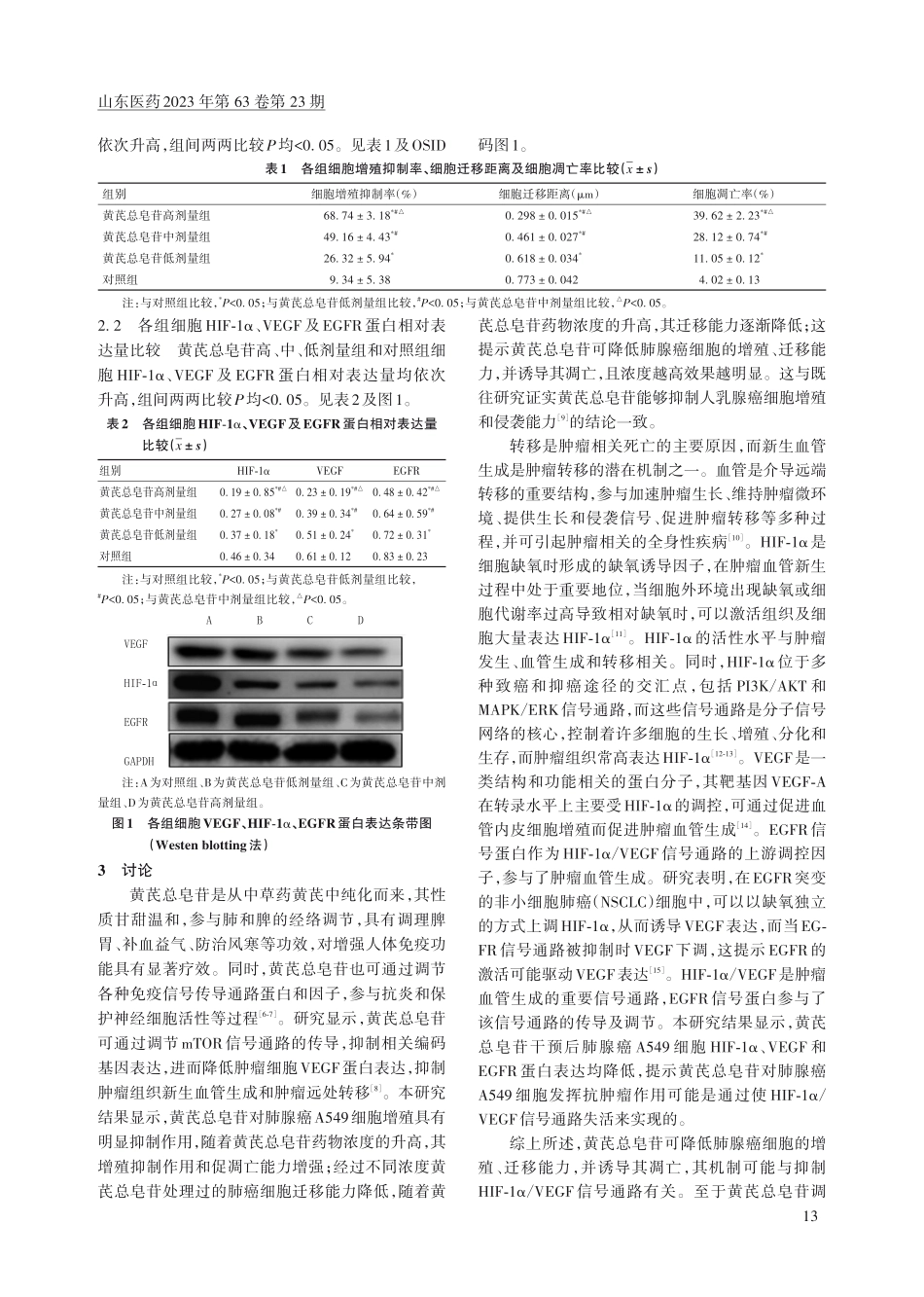
山东医药2023年第63卷第23期黄芪总皂苷对肺腺癌细胞增殖、迁移、凋亡能力及HIF-1α/VEGF信号通路蛋白表达的影响陈静,田伟平,韦小白上海市静安区中心医院肿瘤科,上海200040摘要:目的探讨黄芪总皂苷对肺腺癌细胞增殖、迁移、凋亡能力的影响及其机制是否与缺氧诱导因子1α(HIF-1α)/血管内皮生长因子(VEGF)信号通路有关。方法将肺腺癌A549细胞分为黄芪总皂苷高、中、低剂量组和对照组,分别加入浓度为200、100、50µmol/L的黄芪总皂苷和等体积的二甲基亚砜(DMSO),培养24h。采用CCK-8法检测细胞增殖能力,细胞划痕实验检测细胞迁移能力,流式细胞术检测细胞凋亡率,Westernblotting法检测HIF-1α、VEGF及表皮生长因子受体(EGFR)蛋白表达。结果黄芪总皂苷高、中、低剂量组和对照组细胞增殖抑制率、细胞凋亡率依次降低,细胞迁移距离依次升高,组间两两比较P均<0.05。黄芪总皂苷高、中、低剂量组和对照组细胞HIF-1α、VEGF及EGFR蛋白相对表达量均依次升高,组间两两比较P均<0.05。结论黄芪总皂苷可降低肺腺癌细胞的增殖、迁移能力,并诱导其凋亡,且随浓度升高而更明显,其机制可能与抑制HIF-1α/VEGF信号通路有关。关键词:黄芪总皂苷;肺腺癌细胞;细胞增殖;细胞迁移;细胞凋亡;缺氧诱导因子1α;血管内皮生长因子;表皮生长因子受体doi:10.3969/j.issn.1002-266X.2023.23.003中图分类号:R734.2文献标志码:A文章编号:1002-266X(2023)23-0011-04Effectsoftotalastragalosidesonproliferation,migration,apoptosisandHIF-1α/VEGFsignalingpathwayproteinexpressionoflungadenocarcinomacellsCHENJing,TIANWeiping,WEIXiaobaiDepartmentofOncology,Jing'anDistrictCentralHospital,Shanghai200040,ChinaAbstract:ObjectiveToinvestigatetheeffectsoftotalastragalosidesontheproliferation,migrationandapoptosisoflungadenocarcinomacellsandwhetherthemechanismisrelatedtothehypoxia-inducingfactor1α(HIF-1α)/vascularendothelialgrowthfactor(VEGF)signalingpathway.MethodsLungadenocarcinomaA549cellsweredividedintothehigh-dose,medium-doseandlow-dosetotalastragalosidesgroupsandcontrolgroup,whichwereaddedwith200,100and50µmol/Ltotalastragalosidesandequalvolumeofdimethylsulfoxide(DMSO),respectively,andwereculturedfor24h.CellproliferationcapacitywasdeterminedbyCCK-8assay,cellm...