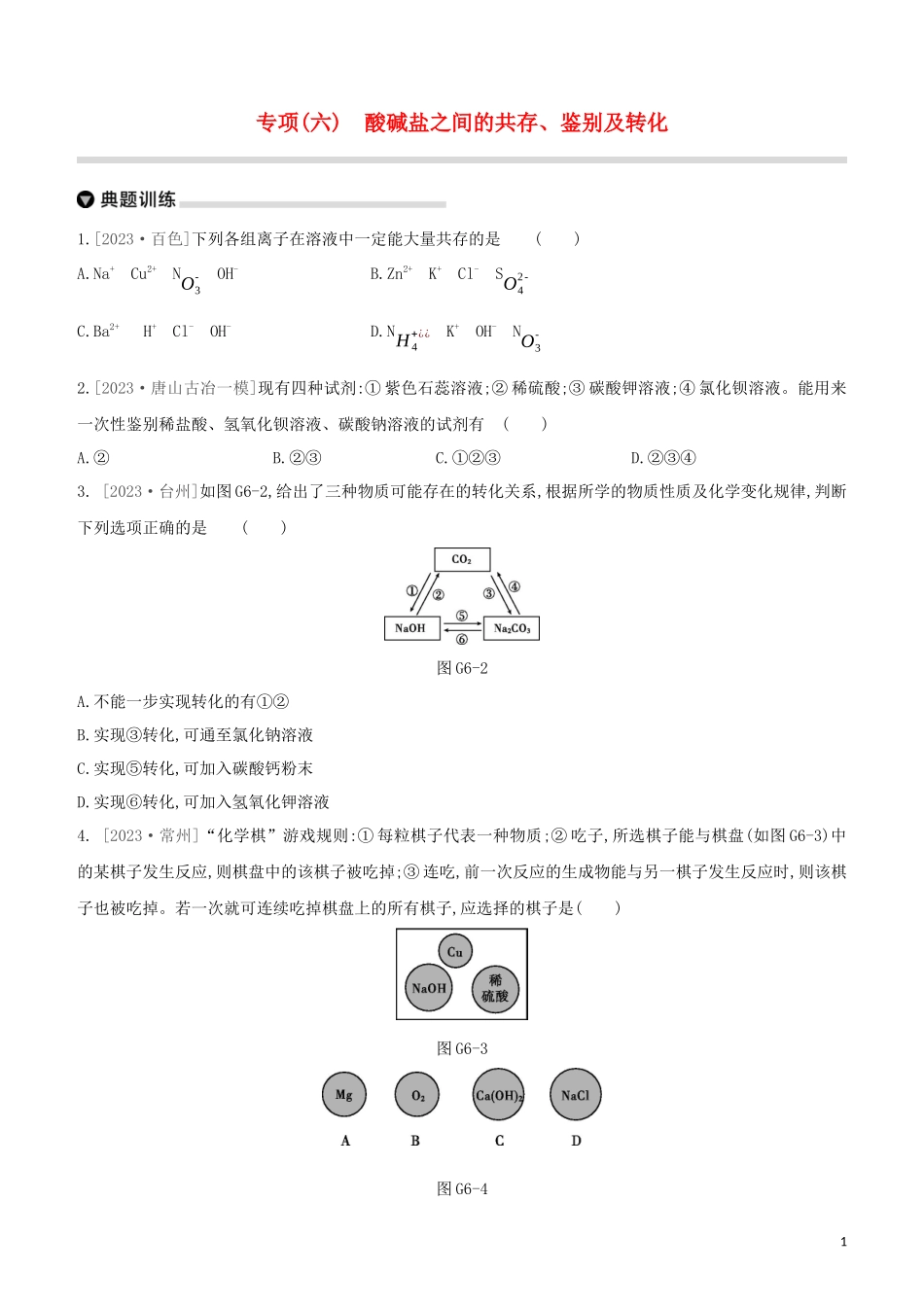
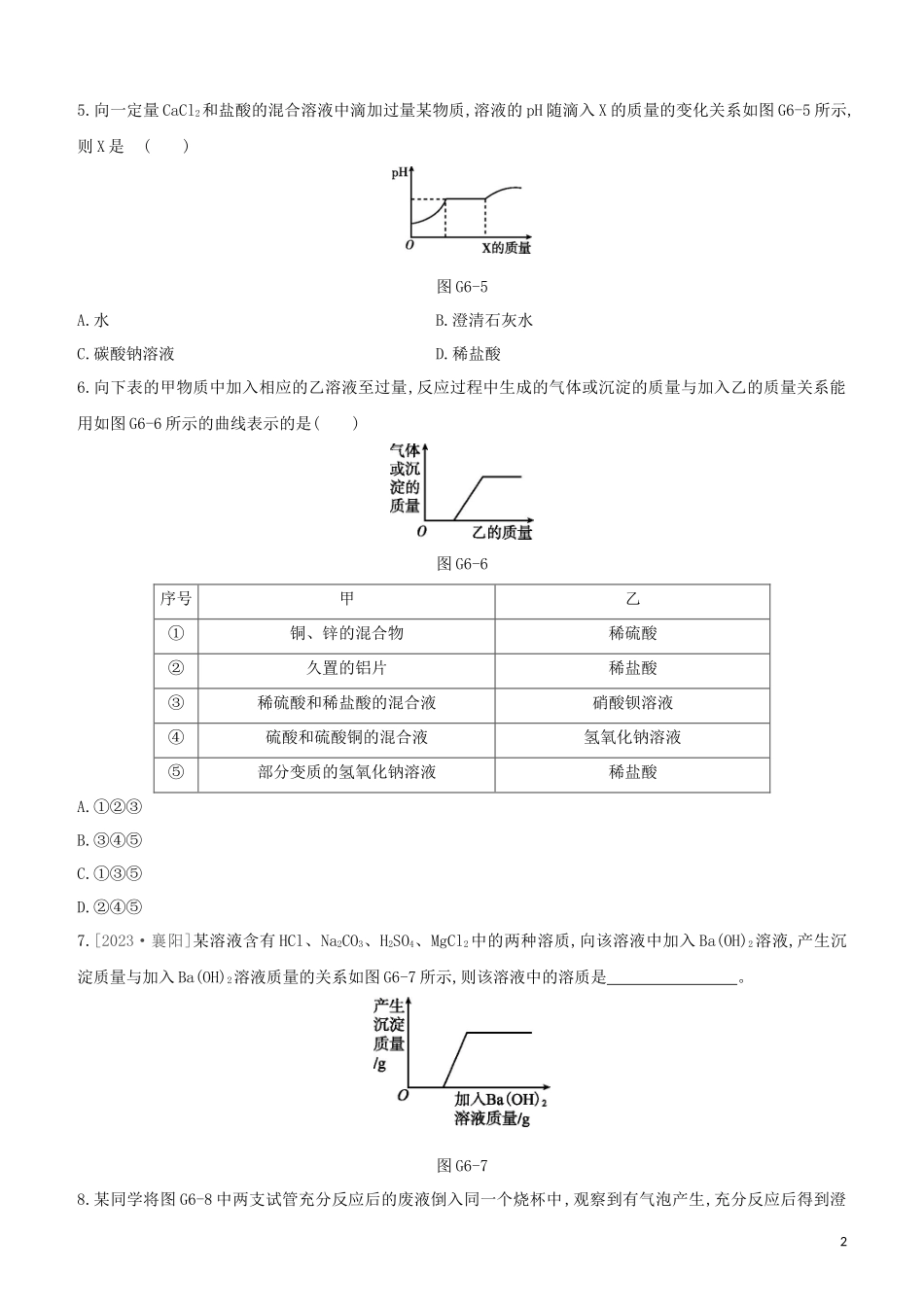
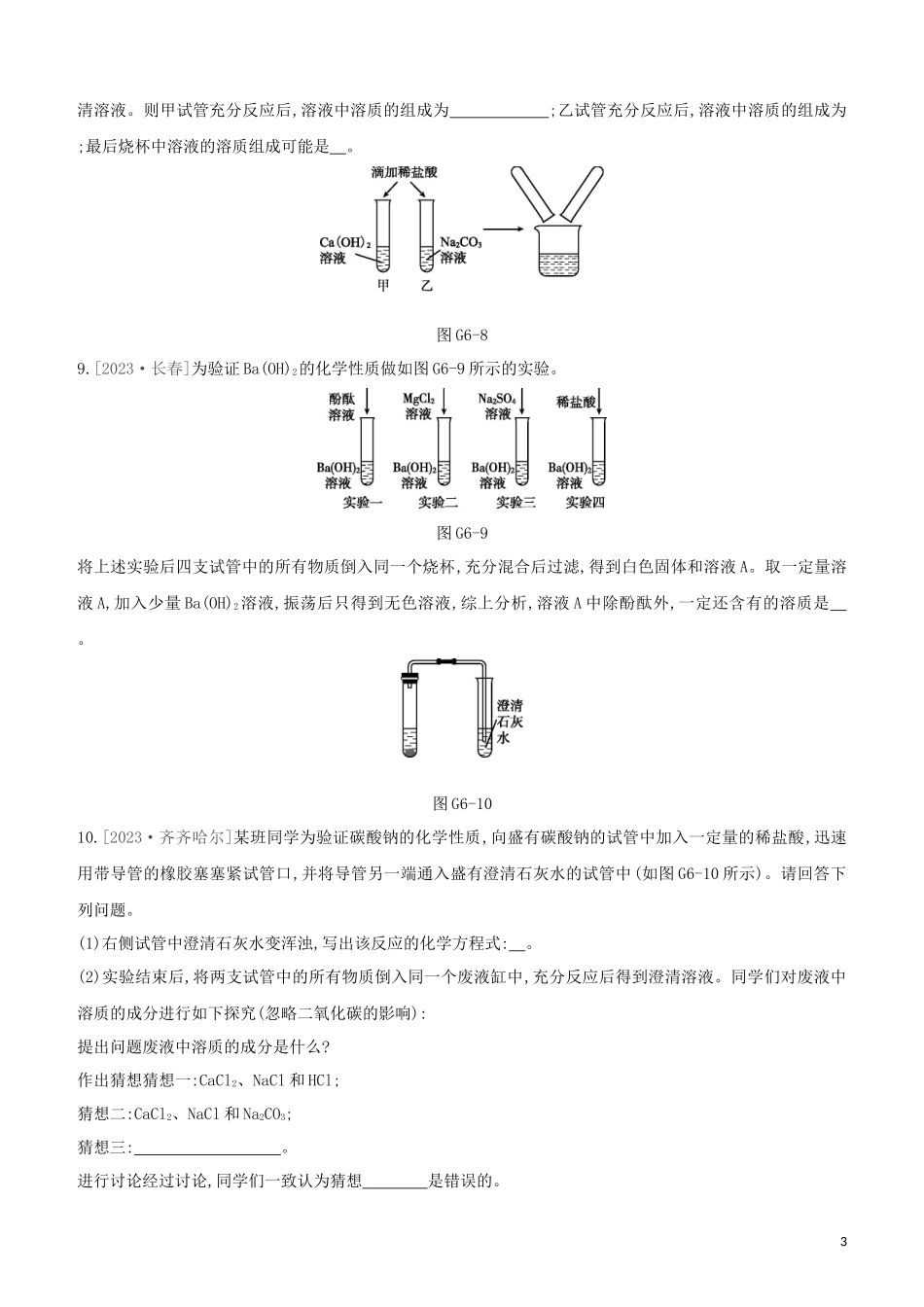
专项(六)酸碱盐之间的共存、鉴别及转化1.[2023·百色]下列各组离子在溶液中一定能大量共存的是()A.Na+Cu2+NO3-OH-B.Zn2+K+Cl-SO42-C.Ba2+H+Cl-OH-D.NH4+¿¿K+OH-NO3-2.[2023·唐山古冶一模]现有四种试剂:①紫色石蕊溶液;②稀硫酸;③碳酸钾溶液;④氯化钡溶液。能用来一次性鉴别稀盐酸、氢氧化钡溶液、碳酸钠溶液的试剂有()A.②B.②③C.①②③D.②③④3.[2023·台州]如图G6-2,给出了三种物质可能存在的转化关系,根据所学的物质性质及化学变化规律,判断下列选项正确的是()图G6-2A.不能一步实现转化的有①②B.实现③转化,可通至氯化钠溶液C.实现⑤转化,可加入碳酸钙粉末D.实现⑥转化,可加入氢氧化钾溶液4.[2023·常州]“化学棋”游戏规则:①每粒棋子代表一种物质;②吃子,所选棋子能与棋盘(如图G6-3)中的某棋子发生反...