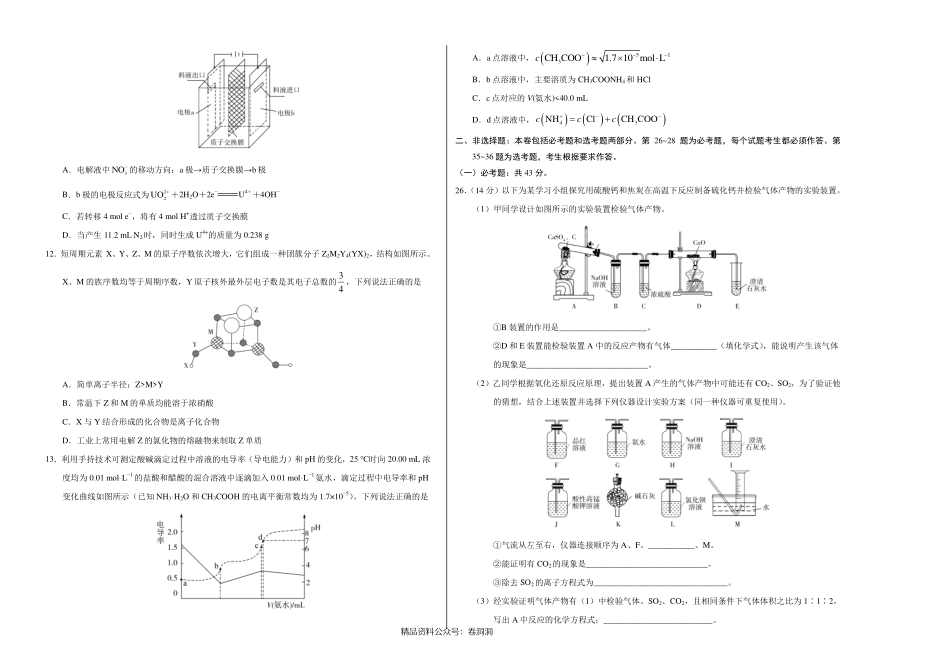
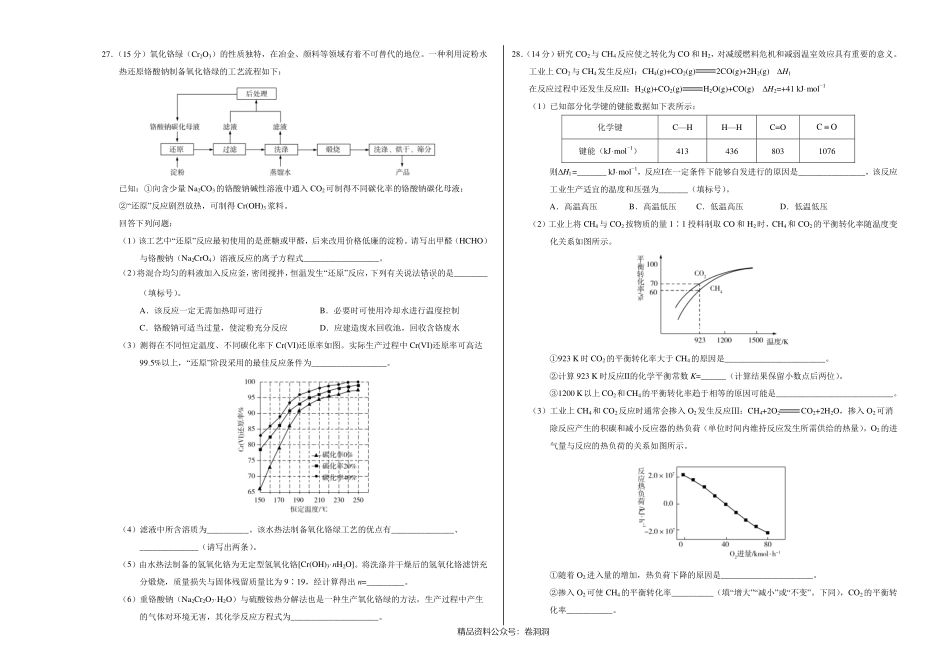
精品资料公众号:卷洞洞绝密★启用前全国名校2020年高三5月大联考考后强化卷(新课标Ⅰ卷)化学本卷满分100分,考试时间50分钟。注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。3.考试结束后,将本试卷和答题卡一并交回。可能用到的相对原子质量:H1C12N14O16Mg24Al27S32Cr52Fe56U238一、选择题:本题共7个小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。7.中国人民在悠久的历史中创造了绚丽多彩的中华文化,下列说法错误的是A.“木活字”是由元代王祯创制的用于印刷的活字,“木活字”的主要成分是纤维素B.“指南针”是我国古代四大发明之一,由天然磁石制成,磁石的主要成分是Fe2O3C.“苏绣”是用蚕丝线在丝绸或其他织物上绣出图案的工艺,蚕丝的主要成分是蛋白质D.“黑陶”是一种传统工艺品,用陶土烧制而成,其主要成分为硅酸盐8.北京冬奥会将于2022年举办,节俭办赛是主要理念。在场馆建设中用到一种耐腐、耐高温的表面涂料是以某双环烯酯为原料制得,该双环烯酯的结构如图所示()。下列说法正确的是A.该双环烯酯的水解产物都能使溴水褪色B.1mol该双环烯酯能与3molH2发生加成反应C.该双环烯酯分子中至少有12个原子共平面D.该双环烯酯完全加氢后的产物的一氯代物有7种9.某课外活动小组设计如图所示装置制取较多量乙酸乙酯。已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH。②相关有机物的沸点:试剂乙醚乙醇乙酸乙酸乙酯沸点(℃)34.778.511877.1下列说法错误的是A.装置中球形干燥管既能冷凝蒸气又能防止倒吸B.反应结束后大试管中的现象是:溶液分层,下层无色油状液体,上层溶液颜色变浅C.从大试管中分离出的乙酸乙酯中还含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,过滤分离出乙醇D.最后加入无水硫酸钠,然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯10.乙炔在Pd表面选择加氢的反应机理如图所示。其中吸附在Pd表面上的物种用*标注。下列有关说法正确的是A.吸附反应为吸热反应B.该正反应历程中最大能垒(活化能)为85kJ·mol−1C.Pd为固体催化剂,其表面积大小对催化效果无影响D.C2H+H*→C2H只有化学键的形成过程11.在乏燃料后处理流程中,四...