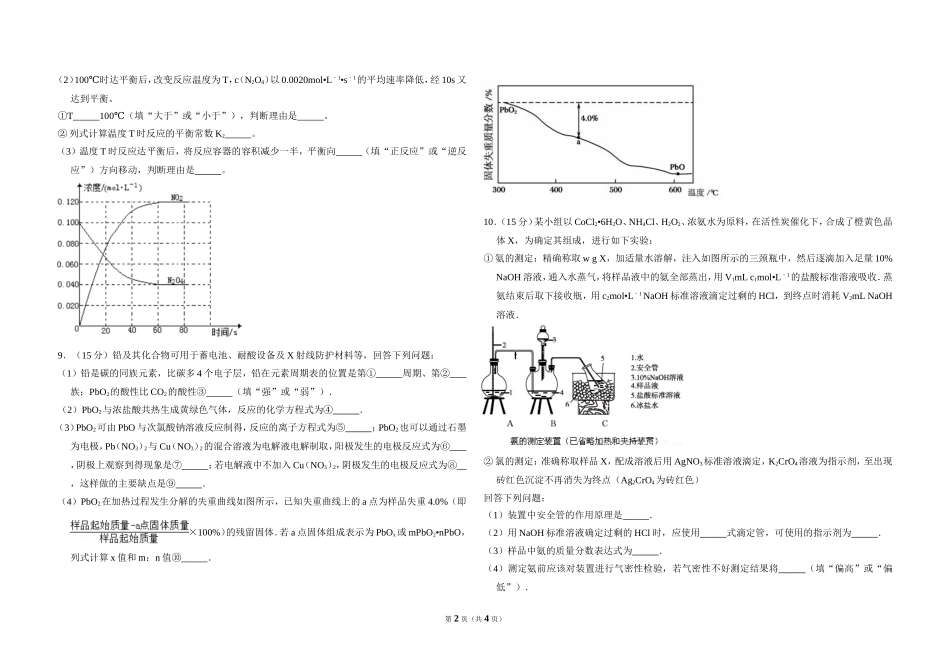
2014年全国统一高考化学试卷(新课标Ⅱ)一、选择题:本题共7小题,每小题6分,在每小题给出的四个选项中,只有一项是符合题目要求的.1.(6分)下列过程没有发生化学反应的是()A.用活性炭去除冰箱中的异味B.用热碱水清除炊具上残留的油污C.用浸泡过高锰酸钾溶液的硅藻土保鲜水果D.用含硅胶、铁粉的透气小袋与食品一起密封包装2.(6分)四联苯的一氯代物有()A.3种B.4种C.5种D.6种3.(6分)下列反应中,反应后固体物质增重的是()A.氢气通过灼热的CuO粉末B.二氧化碳通过Na2O2粉末C.铝与Fe2O3发生铝热反应D.将锌粒投入Cu(NO3)2溶液4.(6分)下列图示实验正确的是()A.除去粗盐溶液中不溶物B.碳酸氢钠受热分解C.除去CO气体中的CO2气体D.乙酸乙酯的制备演示实验5.(6分)一定温度下,下列溶液的离子浓度关系式正确的是()A.pH=5的H2S溶液中,c(H+)=c(HS﹣)=1×105﹣mol•L1﹣B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH﹣)+c(HC2O4﹣)D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③6.(6分)2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,下列叙述错误的是()A.a为电池的正极B.电池充电反应为LiMn2O4═Li1x﹣Mn2O4+xLiC.放电时,a极锂的化合价发生变化D.放电时,溶液中Li+从b向a迁移7.(6分)室温下将1mol的CuSO4•5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2;CuSO4•5H2O受热分解的化学方程式为:CuSO4•5H2O(s)═CuSO4(s)+5H2O(l),热效应为△H3.则下列判断正确的是()A.△H2>△H3B.△H1>△H3C.△H1=△H2+△H3D.△H1+△H2>△H3二、非选择题:包括必考题和选考题两部分,第22题~第32题为必考题,每个试题考生都必须作答,第33题~第40题为选考题,考生根据要求作答8.(13分)在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)⇌2NO2(g),随温度的升高,混合气体的颜色变深。回答下列问题:(1)反应的△H0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示在0~60s时段,反应速率v(N2O4)为mol•L1﹣•s1﹣;反应的平衡常数K1为。第1页(共4页)(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol•L1﹣•s1﹣的平均速率降低,经10s又达到平衡。①T...