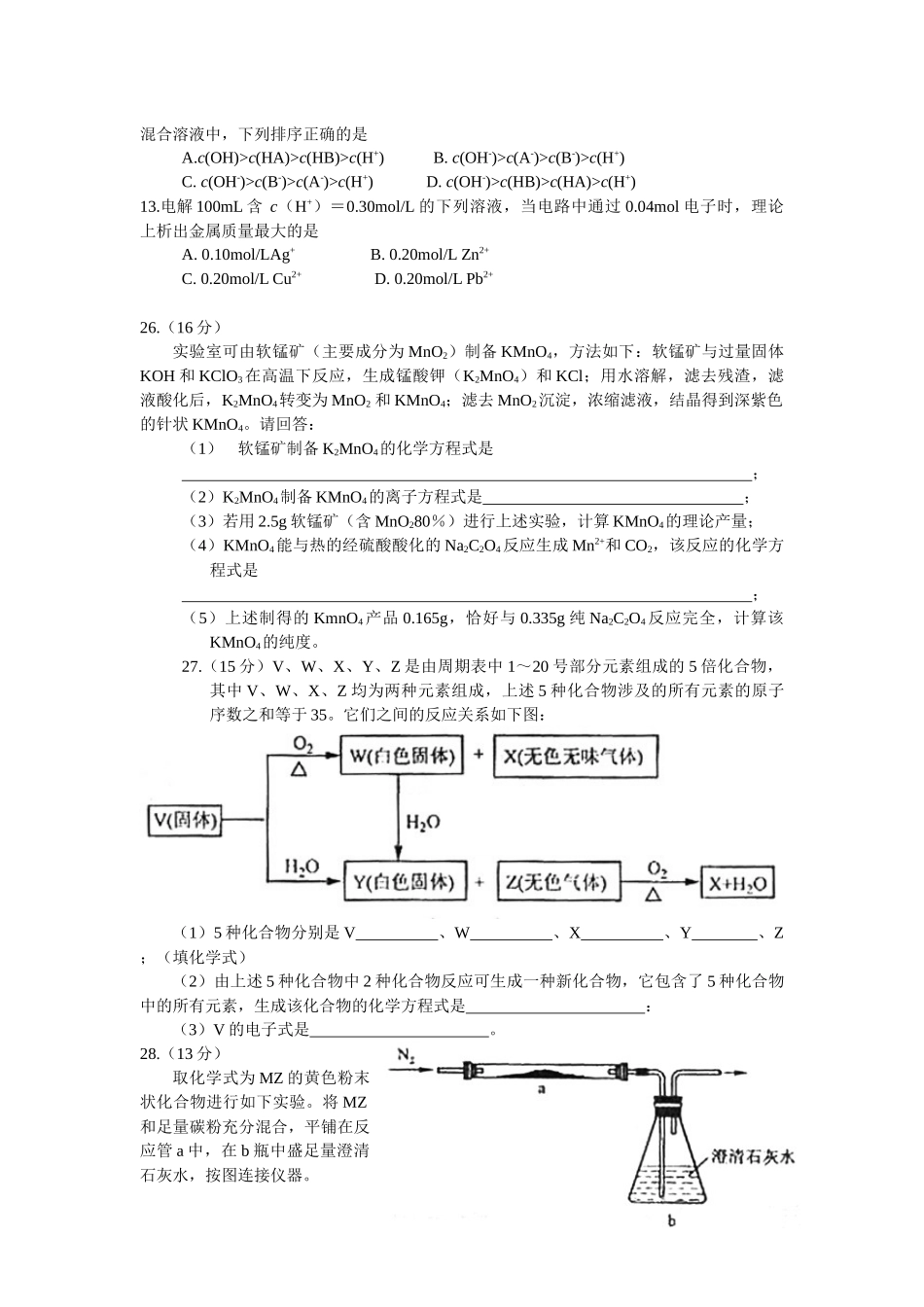
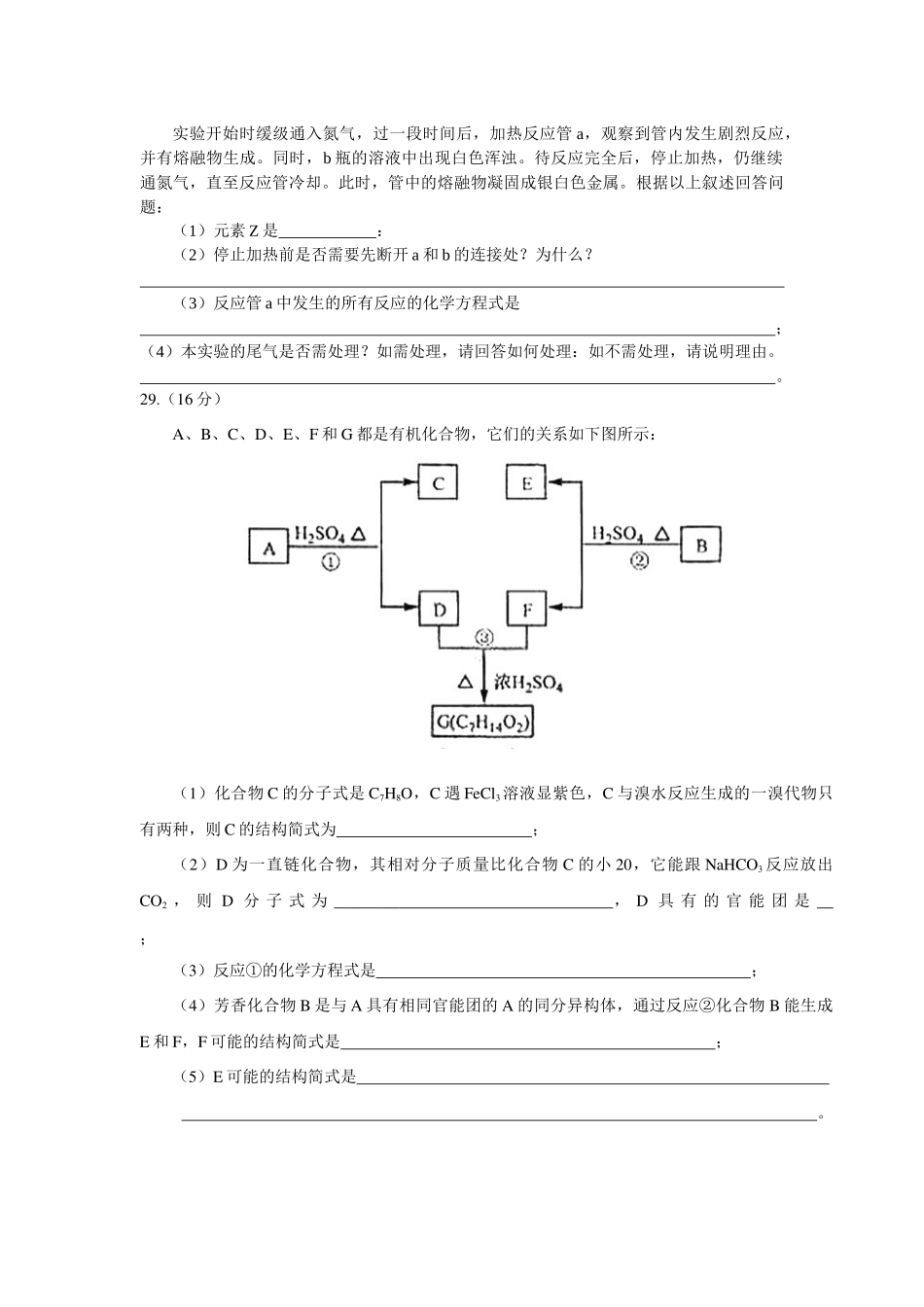
2008年普通高等学校招生全国统一考试(化学)选择题共21小题,第小题6分,共126分。以下数据可供解题时参考:相对原子质量(原子量):HlC12O16Na23K39Mn55Cu64Zn65Ag108Pb207一、选择题(本题共13小题,在每小题给出的四个选项中,只有一项是符合题目要求的。)6.在溶液中加入中量Na2O2后仍能大量共存的离子组是A.NH+4、Ba2+、Cl-、NO-3B.K+、AlO-2、Cl-、SO2-4C.Ca2+、Mg2+、NO-3、HCO-3D.Na+、Cl-、CO2-3、SO2-37.下列化合物,按其品体的熔点由高到低排列正确的是A.SiO2CaClCBr4CF2B.SiO2CsClCF4CBr4C.CsClSiO2CBr4CF4D.CF4CBr4CsClSiO28.下列各组物质不属于同分异构体的是A.2,2-二甲基丙醇和2-甲基丁醇B.邻氯甲苯和对氯甲苯C.2-甲基丁烷和戊烷D.甲基丙烯酸和甲酸丙酯9.下列各组给定原子序数的元素,不能形成原子数之比为11∶稳定化合物的是A.3和17B.1和8C.1和6D.7和1210.下列叙述中正确的是A.NH3、CO、CO2都是极性分子B.CH4、CCl4都是含有极性键的非极性分子C.HF、HCl、HBr、Hl的稳定性依次增强D.CS2、H2O、C2H2都是直线型分子11.已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g).△H=-1025KJ/mol该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是12.已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,下列排序正确的是A.c(OH)>c(HA)>c(HB)>c(H+)B.c(OH-)>c(A-)>c(B-)>c(H+)C.c(OH-)>c(B-)>c(A-)>c(H+)D.c(OH-)>c(HB)>c(HA)>c(H+)13.电解100mL含c(H+)=0.30mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是A.0.10mol/LAg+B.0.20mol/LZn2+C.0.20mol/LCu2+D.0.20mol/LPb2+26.(16分)实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4。请回答:(1)软锰矿制备K2MnO4的化学方程式是;(2)K2MnO4制备KMnO4的离子方程式是;(3)若用2.5g软锰矿(含MnO280%)进行上述实验,计算KMnO4的理论产量;(4)KMnO4能与热的经硫酸酸化的Na2C2O4反应生成Mn2+和CO2,该反应的化学方程式是;(5)上述制得的KmnO4产品0.165g,恰好与0.335g纯Na2C2O4反应完全,计算该KMnO4的纯度。27.(15分)V、W、X、Y、Z是由周期表中1~20号部分元素组成的5倍化合物,其中V、W、X、Z均为...