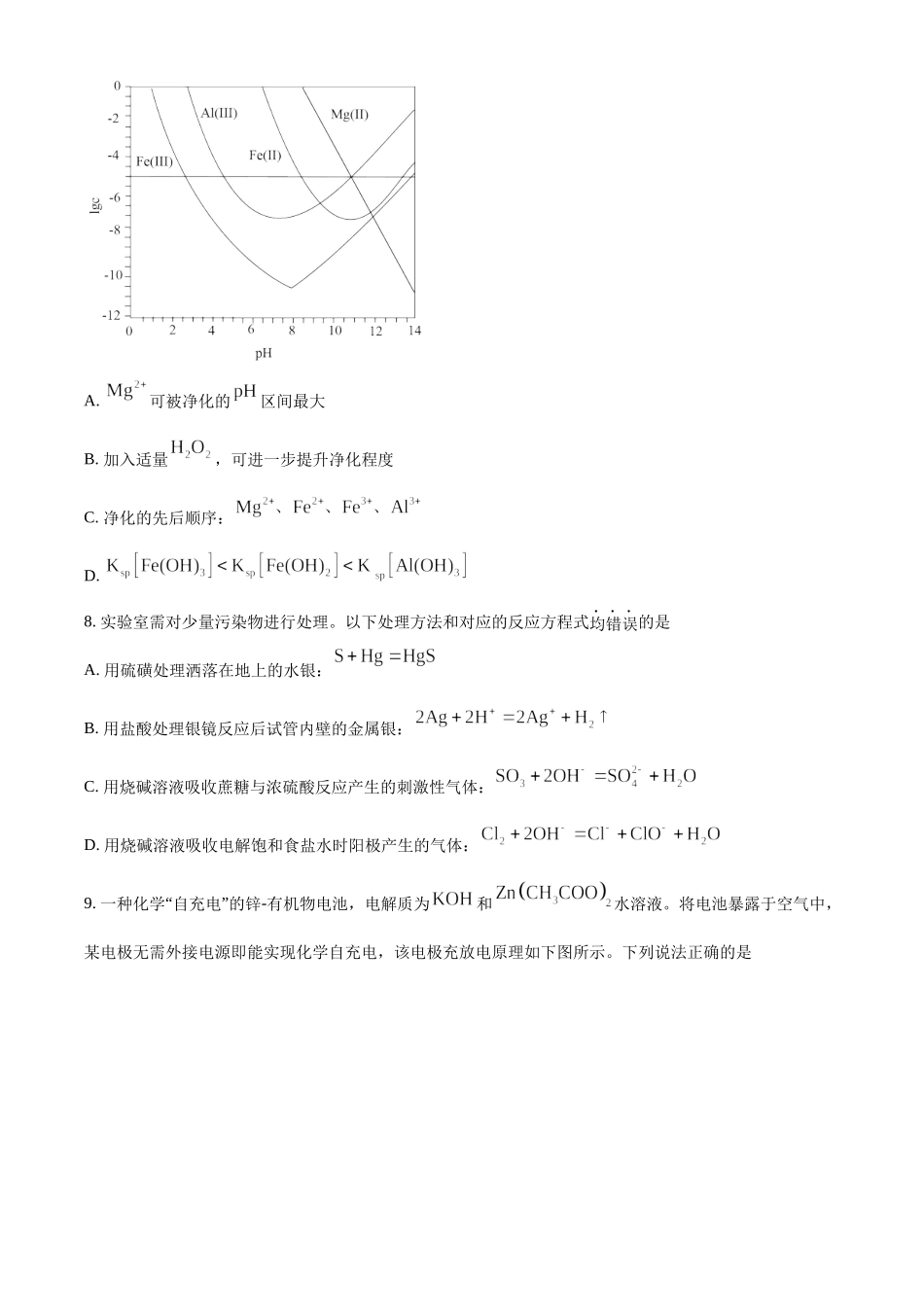
福建省2022年高考化学试题1.福建多个科研机构经过长期联合研究发现,使用和改性的基催化剂,可打通从合成气经草酸二甲酯常压催化加氢制备乙二醇的技术难关。下列说法正确的是A.草酸属于无机物B.与石墨互为同分异构体C.属于过渡元素D.催化剂通过降低焓变加快反应速率2.络塞维是中药玫瑰红景天中含有的一种天然产物,分子结构见下图。关于该化合物下列说法正确的是A.不能发生消去反应B.能与醋酸发生酯化反应C.所有原子都处于同一平面D.络塞维最多能与反应3.常温常压下,电化学还原制氨气的总反应方程式:,设为阿伏加德罗常数的值,下列说法正确的是A.水中含有的孤电子对数为B.每产生失去的电子数为C.氨水中,含有的分子数少于D.消耗(己折算为标况)时,产生的分子数为4.某非线性光学晶体由钾元素(K)和原子序数依次增大的X、Y、Z、W四种短周期元素组成。X与Y、Z与W均为同周期相邻元素,X的核外电子总数为最外层电子数的2倍,Z为地壳中含量最多的元素。下列说法正确的是A.简单氢化物沸点:B.分子的空间构型为三角锥形C.原子半径:D.最高价氧化物对应水化物的碱性:5.探究醋酸浓度与电离度关系的步骤如下,与相关步骤对应的操作或叙述正确的步骤操作或叙述A.Ⅰ用标准溶液标定醋酸溶液浓度滴定时应始终注视滴定管中的液面B.Ⅱ用标定后的溶液配制不同浓度的醋酸溶液应使用干燥的容量瓶C.Ⅲ测定步骤Ⅰ中所得溶液的应在相同温度下测定D.Ⅳ计算不同浓度溶液中醋酸的电离度计算式为A.AB.BC.CD.D6.用铬铁合金(含少量单质)生产硫酸铬的工艺流程如下:下列说法错误的是A.“浸出”产生的气体含有B.“除杂”的目的是除去元素C.流程中未产生六价铬化合物D.“滤渣2”的主要成分是7.锂辉石是锂的重要来源,其焙烧后的酸性浸出液中含有和杂质离子,可在0~14范围内调节对其净化(即相关离子浓度)。时,与关系见下图(碱性过强时和会部分溶解)。下列说法正确的是A.可被净化的区间最大B.加入适量,可进一步提升净化程度C.净化的先后顺序:D.8.实验室需对少量污染物进行处理。以下处理方法和对应的反应方程式均错误的是A.用硫磺处理洒落在地上的水银:B.用盐酸处理银镜反应后试管内壁的金属银:C.用烧碱溶液吸收蔗糖与浓硫酸反应产生的刺激性气体:D.用烧碱溶液吸收电解饱和食盐水时阳极产生的气体:9.一种化学“自充电”的锌-有机物电池,电解质为和水溶液。将电池暴露于空气中,某电极无需外接电源即能实现化学自充电,该电极充放电原理如下图所示。下列说法正确的是A.化学...