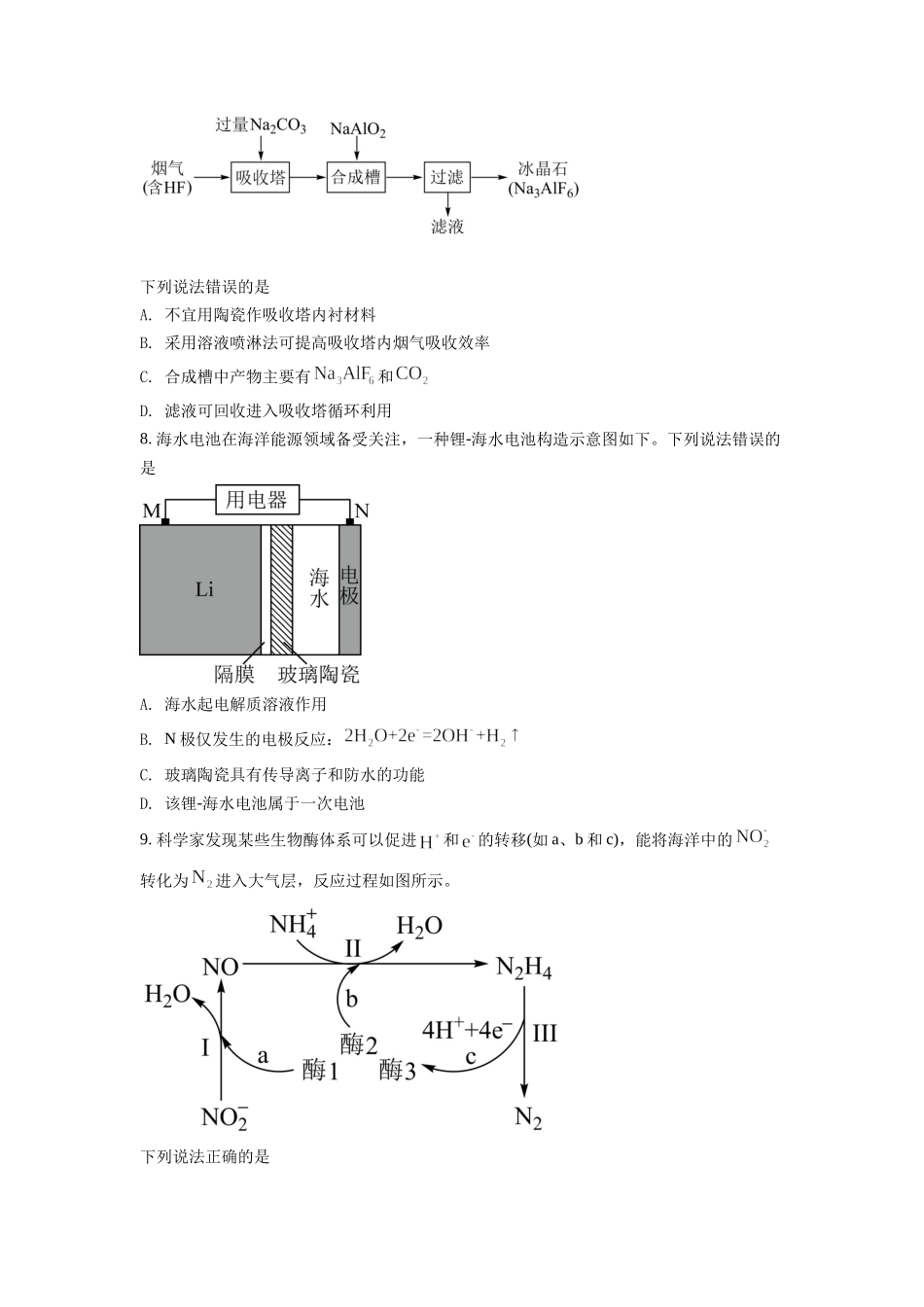
湖南省2022年普通高中学业水平选择性考试化学注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在本试卷和答题卡上。2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上,写在本试卷上无效。3.考试结束后,将本试卷和答题卡一并交回。可能用到的相对原子质量:H1C12N14O16S32Cl35.5K39Fe56Se79Ba137一、选择题:本题共10小题,每小题3分,共30分。在每小题给出的四个选项中,只有一项是符合题目要求的。1.化学促进了科技进步和社会发展,下列叙述中没有涉及化学变化的是A.《神农本草经》中记载的“石胆能化铁为铜”B.利用“侯氏联合制碱法”制备纯碱C.科学家成功将转化为淀粉或葡萄糖D.北京冬奥会场馆使用跨临界直冷制冰2.下列说法错误的是A.氢键,离子键和共价键都属于化学键B.化学家门捷列夫编制了第一张元素周期表C.药剂师和营养师必须具备化学相关专业知识D.石灰石是制造玻璃和水泥的主要原料之一3.聚乳酸是一种新型的生物可降解高分子材料,其合成路线如下:图片优化老师请注意一下:中括号内的右侧O去掉(优化后把这些文字删除)下列说法错误的是A.B.聚乳酸分子中含有两种官能团C.乳酸与足量的反应生成D.两分子乳酸反应能够生成含六元环的分子4.化学实验操作是进行科学实验的基础。下列操作符合规范的是A.碱式滴定管排气泡B.溶液加热C.试剂存放D.溶液滴加A.AB.BC.CD.D5.科学家合成了一种新的共价化合物(结构如图所示),X、Y、Z、W为原子序数依次增大的短周期元素,W的原子序数等于X与Y的原子序数之和。下列说法错误的是A.原子半径:B.非金属性:C.Z的单质具有较强的还原性D.原子序数为82的元素与W位于同一主族6.甲基丙烯酸甲酯是合成有机玻璃的单体。旧法合成的反应:新法合成的反应:下列说法错误的是(阿伏加德罗常数的值为)A.的电子式为B.新法没有副产物产生,原子利用率高C.的溶液中的微粒数小于D.的作用是降低反应的活化能,使活化分子数目增多,百分数不变7.铝电解厂烟气净化的一种简单流程如下:下列说法错误的是A.不宜用陶瓷作吸收塔内衬材料B.采用溶液喷淋法可提高吸收塔内烟气吸收效率C.合成槽中产物主要有和D.滤液可回收进入吸收塔循环利用8.海水电池在海洋能源领域备受关注,一种锂-海水电池构造示意图如下。下列说法错误的是A.海水起电解质溶液作用B.N极仅发生的电极反应:C.玻璃陶瓷具有传导离子和防水的功...